Hafniyum, Hf sembolü ve atom numarası 72 olan kimyasal bir elementtir. Adını Kopenhag şehrinin Latince isminden alır, Hafniaelementin keşfedildiği yer. Periyodik tablodaki 4. alt grup (4. grup) veya titanyum grubunda yer alan gümüş grisi, parlak, korozyona dayanıklı geçiş metalidir.
Hafniyum, periyodik tablodaki zirkonyuma çok benzer özelliklere sahiptir. Biyolojik fonksiyonları bilinmemektedir, normalde insan organizmasında meydana gelmez ve toksik değildir.
Hafniyum, periyodik tablodaki keşfedilen son kararlı unsurlardan biriydi. Lutesyum ve tantal arasında başka bir elementin varlığının ilk göstergesi, 1912'de bulunan Moseley yasasından ortaya çıktı. 1914'te Henry Moseley, nadir toprak mineralleri (bugün lantanitler) örneklerinde bu yasaya göre bilinmeyen, ancak atom numarası 72 olan beklenen elementi bulmaya çalıştı. Ama başarısız oldu.
Niels Bohr, 1922'de yayınlanan atom teorisi üzerine yaptığı çalışmasında, lutetiumlu lantanid serisinin sona ereceğini ve bu nedenle 72 elementinin zirkonyuma benzer olması gerektiğini öngördü. Hafniyum sadece bir yıl sonra tespit edilebilirdi: 1923'te Kopenhag'da Dirk Coster ve George de Hevesy X-ışını spektroskopisini kullanarak Norveç zirkonunda keşfetti. Diğer minerallerle ilgili daha fazla araştırma hafniyumun her zaman zirkonyum içeren minerallerde bulunduğunu gösterdi. Jantzen ve Hevesy, iki elementin diamonyum ve dipotasyum florürlerini tekrar tekrar kristalleştirerek onları zirkonyumdan ayırmayı başardılar. Elemental hafniyum daha sonra sodyum ile indirgeme yoluyla elde edilebilir.
Bulunduğu
Kıta kabuğunda 4,9 ppm içeriğine sahip olan Hafniyum, yeryüzünde çok yaygın bir element değildir. Sıklık açısından, brom ve sezyum elementleriyle karşılaştırılabilir ve uzun zamandır bilinen altın ve civadan daha yaygındır. Hafniyum doğal olarak veya kendi minerallerinde oluşmaz. Zirkon ve baddeleyit gibi zirkonyum mineralleri ise her zaman hafniyum içerir; hafniyum miktarı genellikle zirkonyum içeriğinin% 2'sidir (hafniyumun ağırlıkça yüzde 1-5'i). Zirkonyumdan daha fazla hafniyum içeren birkaç mineralden biri, zirkon çeşidi Alvit [(Hf, Th, Zr) SiO4].
Zirkonyuma benzer şekilde, en önemli hafniyum yatakları Avustralya ve Güney Afrika'daki zirkonyum yataklarıdır. Rezervlerin 1,1 milyon ton olduğu tahmin edilmektedir (hafniyum oksit olarak hesaplanmıştır).
Çıkarma ve sunum
Hafniyum elde etmek için zirkonyumdan ayrılması gerekir. Bu, üretim sürecinde mümkün değildir, ancak ayrı bir süreçte gerçekleşir. Ayırma için ekstraksiyon işlemleri kullanılır. Bazı zirkonyum ve hafniyum tuzlarının özel çözücülerdeki farklı çözünürlükleri kullanılır. Bunun örnekleri, nitratların tri-n-butil fosfat içindeki farklı çözünürlükleri ve metil izobutil keton içindeki tiyosiyanatların çözünürlüğüdür. Diğer olası ayırma seçenekleri, iyon değiştiriciler ve uygun bileşiklerin fraksiyonel damıtılmasıdır.
Kroll işleminden sonra, ayrılan hafniyum ilk önce hafniyum (IV) klorüre dönüştürülebilir ve ardından sodyum veya magnezyum ile elemental hafniyuma indirgenebilir.
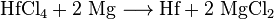
Daha saf hafniyum gerekiyorsa, Van Arkel de Boer işlemi kullanılabilir. Vakum altında ısıtma sırasında hafniyum başlangıçta iyotla reaksiyona girerek hafniyum (IV) iyodür oluşturur. Bu, sıcak bir telde hafniyum ve iyot olarak yeniden parçalanır.

Hafniyum, 100 ton ölçeğinde sadece küçük miktarlarda üretilmektedir. Şirket içinde üretilmez, ancak yakıt çubukları için hafniyum içermeyen zirkonyum ekstraksiyonunun bir yan ürünüdür.
özellikleri
Fiziksel özellikleri

Α-Hf'nin kristal yapısı a = 320 pm,c = 505 pm
Hafniyum, yüksek yoğunluklu (13,31 g / cmXNUMX) gümüşi, parlak bir ağır metaldir.3). Sıcaklığa bağlı olarak iki farklı modifikasyonda kristalleşir. Normal koşullar altında, altıgen yakın bir kürede (α-Hf) kristalleşir ve bu nedenle α-Zr'ye izotipiktir, 1775 ° C'nin üzerinde, vücut merkezli bir kübik yapıya (β-Hf) dönüşür.
Hafniyumun saflığı yüksekse, nispeten yumuşak ve esnektir. Haddeleme, dövme ve çekiçleme ile çalışmak kolaydır. Öte yandan, malzemede oksijen, nitrojen veya karbon izleri varsa kırılgan hale gelir ve işlenmesi zorlaşır. Hafniyumun erime ve kaynama noktaları, sırasıyla 2227 ° C ve 4450 ° C'de gruptaki en yüksek düzeydedir (erime noktası: titanyum: 1667 ° C, zirkonyum: 1857 ° C).
Metal, hemen hemen tüm diğer özelliklerinde daha hafif homolog zirkonyuma benzer. Buna, benzer atomik ve iyonik yarıçaplara (atomik yarıçaplar Zr: 159 pm, Hf: 156 pm) neden olan lantanit kasılması neden olur. Bir istisna, 6,5 g / cm'lik zirkonyumun yoğunluğudur.3 önemli ölçüde daha düşük bir değere sahiptir. Teknik olarak önemli bir fark, hafniyumun nötronları 600 kat daha iyi emebilmesidir. Hafniyumun nükleer enerji santrallerinde zirkonyum kullanımı için ayrılması gerekmesinin nedeni budur.
Hafniyum, 0,08 K geçiş sıcaklığının altında süper iletkendir.
Kimyasal özellikleri
Hafniyum, ısıtıldığında hafniyum dioksit oluşturmak için oksijenle reaksiyona giren bir baz metaldir. Nitrojen, karbon, bor ve silikon gibi diğer metal olmayanlar da bu koşullar altında bileşikler oluşturur. Oda sıcaklığında hızlı bir şekilde yoğun bir oksit tabakası oluşur, bu da metali pasifleştirir ve daha fazla oksidasyondan korur.
Hafniyum, normal koşullar altında pasifleşmesinden dolayı çoğu asitte stabildir. Hidroflorik asitte hızla aşınır; sıcak, konsantre sülfürik ve fosforik asitte fark edilir korozyon oluşur. Su regia dahil hidroklorik asit-nitrik asit karışımları, oda sıcaklığında bile kısa bir süre hafniyuma maruz bırakılmalıdır; 35 ° C'de, 3 mm / yıldan fazla erozyon hızları beklenmelidir. Sulu bazlarda yaklaşık 100 ° C sıcaklığa kadar dayanıklıdır, malzeme kaldırma genellikle 0,1 mm / yıldan azdır.
izotop
Hafniyumun toplam 35 izotopu ve 18 nükleer izomeri vardır 153Hf den 188Hf biliniyor. Doğal hafniyum, toplam altı farklı izotoptan oluşan karma bir elementtir. En yaygın izotop,% 35,08 frekansla 180Hf. 178% 27,28 ile Hf, 177% 18,61 ile Hf, 179% 13,62 ile Hf, 176% 5,27 ile Hf ve 174% 0,16'da Hf. Tek doğal izotop 174Hf zayıf radyoaktif, yarı ömrü 2 x 10 olan bir alfa yayıcıdır.15 Yıllar. İzotoplar 177Hf ve 179Hf, NMR spektroskopisi yardımıyla tespit edilebilir.
Çekirdek izomer 178 2m31 yıllık yarılanma ömrüne sahip olan HF, uzun ömürlüdür ve aynı zamanda bozunduğunda 2,45 MeV'luk güçlü gama radyasyonu yayar. Bu, uzun bir süre boyunca kararlı olan bir izotopun yaydığı en yüksek enerjidir. Olası bir uygulama, bu çekirdek izomerini güçlü lazerlerde bir kaynak olarak kullanmaktır. 1999'da Carl Collins, izomerin X ışınlarına maruz kaldığında tek seferde enerjisini serbest bırakabileceğini keşfetti. Bununla birlikte, patlayıcılar gibi olası uygulamalar pek olası değildir.
Kullanım
Endüstriyel atıklardan Hafniyum levha
Çıkarılması zor olduğu için hafniyum yalnızca küçük miktarlarda kullanılır. Ana uygulama alanı, hafniyumun nükleer reaktörlerde zincir reaksiyonunu düzenlemek için bir kontrol çubuğu olarak kullanıldığı nükleer teknolojidir. Hafniyum kullanımının diğer olası nötron emici maddelere göre birçok avantajı vardır. Element korozyona karşı çok dayanıklıdır ve nötronlarla nükleer reaksiyon, aynı zamanda yüksek absorpsiyon kesitlerine sahip hafniyum izotopları oluşturur. Yüksek fiyatı nedeniyle, genellikle yalnızca askeri uygulamalar için, örneğin atomik denizaltılardaki reaktörler için uygundur.
Birkaç başka kullanım var. Hafniyum, az miktarda oksijen ve nitrojen ile hızlı bir şekilde reaksiyona girer ve bu nedenle bu maddelerin en küçük miktarlarını ultra yüksek vakumlu sistemlerden uzaklaştırmak için bir alıcı madde olarak kullanılabilir. Metal yandığında çok parlak bir ışık yayar. Bu nedenle, özellikle yüksek ışık verimliliği olan flaş lambalarında hafniyum kullanmak mümkündür. Elementlerden çok kararlı ve yüksek erime noktalı bileşikler, özellikle hafniyum nitrür ve hafniyum karbür yapılabilir.
Niyobyum, tantal, molibden ve tungsten gibi metaller içeren alaşımlarda% 2 hafniyum ilavesi gücü artırır. Özellikle kararlı, yüksek erime noktalı ve ısıya dayanıklı malzemeler oluşturulur.
emniyet
Diğer birçok metal gibi hafniyum da son derece yanıcı ve ince bölünmüş haliyle piroforiktir. Öte yandan, kompakt bir durumda yanıcı değildir. Metal zehirli değildir. Bu nedenlerden dolayı, hafniyum ile çalışırken özel güvenlik düzenlemelerine uyulmasına gerek yoktur.
Bağlantıları
Hafniyum bir dizi bileşik oluşturur. Bunlar çoğunlukla tuzlar veya karışık kristallerdir ve genellikle yüksek erime noktalarına sahiptir. Hafniyumun en önemli oksidasyon durumu + IV'tür, ancak 0'dan + III'e kadar daha düşük oksidasyon durumlarında ve komplekslerde ayrıca negatif oksidasyon durumlarında bileşikler de vardır.
Zirkonyum (IV) oksit
Hafniyum (IV) oksit, çok kararlı ve yüksek erime noktalı bir katıdır. 25'lik yüksek bir nispi geçirgenliğe sahiptir (karşılaştırma için: silikon dioksit: 3,9). Bu nedenle, mikroişlemciler için kontrol bağlantısını (geçidi) izole etmek için yüksek-k dielektrik olarak kullanılabilir. Yapı genişliklerini daha da azaltarak, kaçak akımlar giderek daha büyük bir sorun haline geliyor, çünkü CMOS yapılarının minyatürleştirilmesi ayrıca daha ince kapı yalıtımı gerektiriyor. Tünel etkisi nedeniyle istenmeyen kaçak akım 2 nm'nin altına keskin bir şekilde artar. Bir yüksek-k dielektrik kullanarak, transistörde performans kaybı olmadan (anahtarlama hızında azalma) kaçak akımı azaltmak için dielektrik kalınlığı tekrar artırılabilir. Böylece, daha kalın dielektrikler daha da minyatürleştirmeye izin verir.
Diğer hafniyum bileşikleri
Hafniyum karbür, en yüksek erime noktasına sahip maddelerden biridir. Hafniyum nitrür ve hafniyum borür ile birlikte sert malzemelerden biridir.
Hafniyumun bilinen bazı halojen bileşikleri vardır. Oksidasyon durumunda + IV, hem florür hem de klorür, bromür ve iyodür içerir. Hafniyum (IV) klorür ve hafniyum (IV) iyodür hafniyum üretiminde rol oynamaktadır. Düşük oksidasyon durumlarında, sadece klor ve brom bileşikleri ve hafniyum (III) iyodür bilinmektedir.
Potasyum hexafluoridohafnate (IV) K2[HFF6] hem de amonyum heksaflorididohafnat (IV) (NH)4)2[HFF6Her iki tuz da karşılık gelen zirkonyum komplekslerinden daha çözünür olduğundan, hafniyumun zirkonyumdan ayrılması için kullanılabilir.
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| İsim, sembol, atom numarası | Hafniyum, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||
| dizi | Geçiş metalleri | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, dönem, blok | 4, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüş | çelik grisi | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS numarası | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Yer kabuğunun kütle kesri | 4,2 sayfa / dakika'ya kadar | ||||||||||||||||||||||||||||||||||||||||||||||||
| nükleer | |||||||||||||||||||||||||||||||||||||||||||||||||
| atomik kütle | 178,49 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı (hesaplanmış) | 155 (208) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| elektron konfigürasyonu | [Xe] 4f14 5d2 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. iyonlaşma | 658,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. iyonlaşma | 1440 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. iyonlaşma | 2250 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. iyonlaşma | 3216 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| fiziksel olarak | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel durum | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| modifikasyonlar | iki (α- / β-Hf) | ||||||||||||||||||||||||||||||||||||||||||||||||
| kristal yapı | altıgen şeklinde | ||||||||||||||||||||||||||||||||||||||||||||||||
| yoğunluk | 13,28 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| manyetizma | paramanyetik ( = 7,0 10-5) = 7,0 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| ergime noktası | 2506 K (2233 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| kaynama noktası | 4876 K (4603 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molar hacmi | 13,44 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| buharlaşma ısısı | 630 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| kaynaşma ısısı | 25,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| buhar basıncı | 0,00013 K'da 1970 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||
| sesin hızı | 3010 K'de 293,15 m / s | ||||||||||||||||||||||||||||||||||||||||||||||||
| Özgül ısı kapasitesi | 140 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektriksel iletkenlik | 3,12 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ısı iletkenliği | 23 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| kimyasal | |||||||||||||||||||||||||||||||||||||||||||||||||
| oksidasyon durumları | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normal potansiyel | −1,505 V (HfO2 + 4 H.+ + 4 e- → Hf + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||
| elektronegatiflik | 1,3 (Pauling ölçeği) | ||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| NMR özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| emniyet | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||



