Magnezyum, Mg, atom numarası 12
Magnezyum fiyatı, tarihçesi, oluşumu, çıkartılması ve kullanılması
Magnezyum, element sembolü Mg (Alchemy: symbol) ve atom numarası 12 olan kimyasal bir elementtir. Elementlerin periyodik tablosunda, ikinci ana grupta veya 2'tedir. IUPAC grubu ve dolayısıyla toprak alkali metallere aittir.
Magnezyum, yer kabuğunun en yaygın olan on elementinden biridir. Bitkilerin yaprak yeşillerinde olduğu kadar çok sayıda mineralde de oluşur.
Tarih
Eleman tanımlamasının kökeni literatürde farklı gösterilmiştir:
- "manyetik taş" anlamına gelen eski Yunanca μαγνησία λίθος,
- Doğu Yunanistan'da bir bölge olan Magnisia,
- Magnesia, bugünün Türkiye topraklarında Küçük Asya'da bir şehir.
Bununla birlikte, burada verilen tüm türevler etimolojik olarak mıknatıslardan veya onların adını taşıyan Heros Magnes'lerden kaynaklanıyor gibi görünmektedir.
Magnezyum bileşikleri, element magnezyumun üretilmesinden önceki yüzyıllar boyunca bilinip kullanıldı. Magnezya alba, magnezyum karbonat olarak adlandırılırken, magnezyum, magnezyum oksidin ortak adıydı.
İskoç fizikçi ve kimyager Joseph Black, 18'teki magnezyum bileşiklerinin ilkidir. Yüzyıl sistematik olarak incelendi. Çalışmalarında 1755 De humore asido cibis orto ve magnesia alba, o sırada kireç (kalsiyum karbonat) ve magnesia alba (magnezyum karbonat) arasındaki farkı, o zamanlar sık sık karıştırdı. Magnesia alba'yı yeni bir elementin karbonatı olarak aldı. Bundan dolayı, hiçbir zaman temel magnezyum temsil etmemiş olmasına rağmen Siyah'a genellikle magnezyumun keşfi denir.
1808, Volta kül sütunu yardımıyla elektrolizle nemlendirilmiş Sir Humphry Davy Magnezyum magnezyum hidrürü kazandı - saf bir formda değil, bir cıva katodu ile çalıştığından, bir amalgam olarak. Böylece Magnesia'nın Magnium adını verdiği yeni bir metalin oksidi olduğunu gösterdi.
Kuru magnezyum klorürü indirgeyici ajan olarak potasyumla ısıtmak suretiyle 1828, Fransız kimyager Antoine Bussy için az miktarda saf magnezyum üretmeyi başardı. 1833, erimiş magnezyum klorürün elektrolizi ile magnezyum yapan ilk kişiydi. Bu deneylere dayanarak, Alman kimyager Robert Wilhelm Bunsen, 1840 ve 1850 yıllarında, geliştirdiği Bunsen elementini kullanarak erimiş tuzların elektrolizi ile magnezyum üretimi için işlemler üzerinde çalıştı. 1852, erimiş susuz magnezyum klorürden daha büyük miktarlarda magnezyum üretmek için bir elektroliz hücresi geliştirmiştir. Bu işlem bugün hala magnezyumun geri kazanılması için tercih edilmektedir.
Magnezyumun teknik üretimi, Fransa'da Henri Etienne Sainte-Claire Deville ve H. Caron'un bir prosedürünün ardından başladı. Sözde Deville-Caron işleminde, susuz magnezyum klorür ve kalsiyum florür karışımı sodyum ile azaltılır. İngiltere'de Johnson Johnson, benzer bir işlem kullanarak 1857'i üretmeye başladı. Ancak, üretim zorlukları nedeniyle, bu erken girişimler ekonomik değildi.
Bulunduğu
Magnezyum, elemental formda reaktivitesinden dolayı doğada mevcut değildir. Bir mineral olarak, ağırlıklı olarak karbonatlar, silikatlar, klorürler ve sülfatlar şeklinde ortaya çıkar. Dolomit formunda, bir magnezyum minerali bile dağ oluşturur. B. Dolomitlerde.
En önemli mineraller dolomit CaMg (CO3) 2, manyezit (bitterpar) MgCO3, olivin (Mg, Fe) 2 [SiO4], enstatit MgSiO3 ve kieserit MgSO4 · H2O'dur.
Diğer mineraller:
- Yılanlı Mg3 [Si2O5] (OH) 4
- Talk Mg3 [Si4O10] (OH) 2
- Sepiyolit Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (SOX NUMBER) 4 · 2 H6O
- Karnalit KMgCl3 · 6 H2O
- Spinel MgAl2O4
Suda çözündüğünde kalsiyum ile birlikte suyun sertliğine neden olur. Deniz suyunda 1 kg / m³'den fazla bulunur.
Çıkarma ve sunum
Magnezyumun çıkarılması esas olarak iki yolla gerçekleşir:
- Aşağı Akım Hücrelerinde Erimiş Magnezyum Klorürün Erimiş Akım Elektrolizi: Düşme hücreleri aşağıdan ısıtılan büyük demir oluklardan oluşur. Anotlar, halka şeklindeki bir katodun uçlarıyla çevrili, gömülü grafit çubuklardan hizmet eder. Metalik magnezyum, erimiş tuz üzerinde birikir ve azarlanır. Elde edilen klor gazı hücrenin üst kısmında toplanır ve magnezyum oksitten magnezyum klorit üretmek için tekrar kullanılır. Magnezyum klorürün erime noktasını düşürmek için erimiş tuza kalsiyum klorür ve sodyum klorür eklenir.
- Magnezyum oksidin termal indirgenmesiyle (Pidgeon işlemi): Krom-nikel çelikten yapılmış bir kapta yanmış dolomit, barit ve ferrosilikon gibi bir indirgeyici madde doldurulur. Daha sonra boşaltılır (gazdan dışarı pompalanır) ve 1160 ° C'ye ısıtılır. Buhar halindeki magnezyum, fırının dışındaki su soğutmalı kafa borusunda yoğunlaşır. Geri kazanılan magnezyum ayrıca vakumlu damıtma ile arıtılır.
Pidgeon süreci günümüzde en önemli üretim sürecidir ve çoğunlukla Çin'de kullanılmaktadır.
Dünyadaki magnezyum üretiminin% 88'i, 2015'in yaklaşık 800.000 t magnezyum metali ürettiği Çin'de gerçekleşir. Bunu, her pazarın yalnızca yüzde birkaçını Rusya, İsrail ve Kazakistan paylaşıyor.
Pidgeon işlemi ile 1 kg magnezyum üretimi, yaklaşık 2 kg'lık bir CO31 eşdeğeri olan sera gazları üretmektedir (karşılaştırma için: 1 kg çelik için, CO0,5 eşdeğerleri 2 ve 2 kg arasında oluşturulmaktadır).
Magnezyum 60'ten daha fazla mineralde bulunsa da, sadece dolomit, manyezit, brucit, karnallit, talk ve olivin ticari öneme sahiptir.
Mg2 + katyon, deniz suyunda en çok bulunan ikinci katyon olup, deniz suyunu ve deniz tuzu, magnezyumun ticari kaynaklarını cazip kılar. Çıkarmak için, magnezyum hidroksit çökeltisi oluşturmak üzere deniz suyuna kalsiyum hidroksit eklenir.
Magnezyum hidroksit (brucite) suda çözünmez ve süzüldü ve konsantre magnezyum klorit verecek şekilde hidroklorik asit ile reaksiyona sokulabilir.
Elektroliz, magnezyum klorürden magnezyum klorit üretir.
özellikleri
Sağlam, gümüşi parlak magnezyum alaşımı alüminyumdan yaklaşık üçte bir daha hafiftir. Saf magnezyum düşük bir mukavemet ve sertliğe sahiptir. Modülü 45 GPa ile ilgilidir. Havada magnezyum, alüminyuma karşın tamamen opak olmayan bir oksit tabakası ile kaplanır. Bunun nedeni, magnezyum oksidin, magnezyumun kendisinden daha düşük bir molar hacme sahip olmasıdır (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. Tüylenme-Bedworth oranı.
İnce şeritler veya folyolar kolayca tutuşur. Magnezyum oksit MgO ve az miktarda magnezyum nitrür Mg3N2'e kadar parlak beyaz bir alevle havada yanar. Taze yapılmış magnezyum tozu kendiliğinden tutuşuncaya kadar havada ısınabilir. Tehlikeli reaksiyonların, özellikle erimiş sıvı ile olan yüksek sıcaklıklarda beklenmesi beklenir. Ayrıca karbon monoksit, azot oksit ve kükürt dioksit gibi birçok okside magnezyum yakar.
Magnezyum, hidrojen oluşturmak için su ile reaksiyona girer:
Magnezyumun suyla reaksiyonu
Bu, reaksiyonu (pasivasyon) büyük ölçüde durduran, zayıf şekilde çözünür bir magnezyum hidroksit kaplaması oluşturur. Amonyum tuzları gibi zayıf asitler bile, hidroksit iyonlarını suya dönüştürdüğü ve çözünür tuzlar oluşturduğu için hidroksit katmanını çözmek için yeterlidir. Pasivasyon olmadan, ekzotermik reaksiyon şiddetli bir şekilde ilerler; Magnezyum tozu ne kadar ince olursa o kadar şiddetli olur. Hava ile, salınan hidrojen kolayca patlayıcı bir karışım oluşturur (oksihidrojen gazı).
Magnezyum, magnezyum oksit ve karbon oluşturmak için ekzotermal olarak karbon dioksit ile reaksiyona girer:
Magnezyumun karbondioksit ile reaksiyonu
Bu nedenle, karbondioksit magnezyum yangınlarını söndürmez, ancak onları yakar.
Alüminyumun aksine hidroflorik asit ve bazlara karşı nispeten dirençlidir. Bunun nedeni, Mg (OH) 2 iyonlarının daha fazla oluşumunu önleyen magnezyum florürün (MgF3) düşük çözünürlüğüdür.
izotop
21Mg ve 19Mg magnezyum bilinen arasında toplam 40 izotopları vardır. Bunlardan üçü, 24Mg, 25Mg ve 26Mg izotopları sabittir ve doğada meydana gelir. Doğal izotopik bileşimin daha büyük bir oranına sahip olan izotop,% 24 ile 78,99Mg'dir, 25Mg,% 10,0 ve% 26Mg 11,01 arasındadır. En uzun ömürlü dengesiz izotoplar, beta bozunması durumunda yarı ömürlü bir 28 saatle 20,915Al'e dönüşen 28Mg ve beta bozunması durumunda yarı ömürlü bir 27Al'a indirgenen 9,435Mg'ye ve 27 dakikaya kadar da azalır. Diğer tüm izotopların sadece kısa yarım ömürleri veya milisaniyeleri vardır.
Kullanım
Metalik magnezyum
Magnezyum tozu ve tel, daha önce flaş tozu olarak kullanılan yangın söndürme aletlerinde, bombalarda ve hafif mühimmatta kullanılır. Çoğunlukla, magnezyum çubukları, daha soylu metallerin parçalarını korozyondan koruyan kurban anotlar gibi davranır.
Metalurjide magnezyum çok yönlü kullanım bulur,
- Kroll işleminde titanyumun geri kazanılması için bir indirgeyici madde olarak,
- uranyum, bakır, nikel, krom ve zirkonyumun geri kazanımı için bir indirgeyici madde olarak,
- AlSiMg ve AlMg gruplarının alüminyum alaşımlarının bir bileşeni olarak,
- demir ve çeliğin kükürt gidermesi için magnezyum granülleri olarak,
- sfero dökme demir için agrega olarak,
- uçak ve motorlu taşıtların inşası için bir grup standartlaştırılmış hafif alaşımın temeli olarak (bu erimeler, hava girişine ve oksidasyona karşı koruma için erimiş magnezyum klorürün bir kaplama tabakasını gerektirir),
- su altında yanan meşaleler için yakıt olarak.
Organik kimyada Grignard bileşiklerini yapmak için kullanılır.
Magnezyum çok kolay tutuşabildiği için, çok sağlam bir çakmak olarak da kullanılır. Fire Starter Kitleri olarak pazarlanan bu magnezyum bloklar, bir tarafında, çakmaktaşı çakmaktaşı gibi havada kendiliğinden tutuşan bir çubuğa sahiptir. İşlem, Magnezyumun cüruf rolü oynadığı taş devri çakmaktaşı ve cüruf yakma yöntemine çok benzer. İlk olarak, cipsler magnezyum bloktan bir bıçakla kazınır ve gerçek yakıtın üzerine veya altına yerleştirilir. Daha sonra, arkadaki "çakmaktaşı" (örneğin bıçağın arkasında) kazıyarak, kıvılcımlar, onları tutuşturmak için magnezyum dönüşlerine mümkün olduğunca yakın üretilir.
magnezyum alaşımları
Alüminyum ve alaşımlarından daha önemli hale getiren magnezyum alaşımlarının en önemli özelliği, sağladıkları hafif yapıdır. 1,75 g / cm³ civarında bir yoğunluğa sahip, 2,75 g / cm with yoğunluğunda alüminyum hafif konstrüksiyona olan fark açıktır. Ek olarak, 430 ve 630 ° C arasındaki erime aralığı, yani enerji tasarrufu daha düşüktür. Bununla birlikte, çekme dayanımı ve sertlik gibi mekanik özellikler, alüminyum alaşımlarından önemli ölçüde daha düşüktür. Düşük yoğunluklu magnezyum, mobil uygulamalar için daha erken ilgi çekici hale geldi. İlk büyük uygulama, Sert Zeplin gemileri için iskele yapımında Birinci Dünya Savaşı'ndan önce gerçekleşti. Otomobillerde, konut parçaları üretmek ve her türlü mobil uygulama için jant üretmek için magnezyum alaşımları kullanılmış, 1930 uçak yapımında daha fazla enerji tasarruflu uçuş ve daha yüksek yük yükü sağlaması nedeniyle, uçak yapımında magnezyum alaşımlarını giderek daha fazla kullanmıştır. Bütün bunlar Almanya'da (Griesheim kimyasal fabrikasından Elektron) ve ABD'de de 1940 sonrasında hızlı bir şekilde magnezyum üretiminin genişlemesine yol açtı. "Elektron", üretime başladıktan hemen sonra ilk magnezyum alaşımlarının ticari markası olmuştur.
Magnezyum dökümünün diğer kullanımları, teknik gelişim sırasında, kısmen savaşla ilgili, kısmen yapıcı olarak ileriye dönük ve aynı zamanda alaşımları optimize ederken kendilerine sunulan tekliflerdir. Magnezyum esaslı malzemeler olarak, Mg-Al, Mg-Mn, Mg-Si, Mg-Zn alaşımları ve son olarak Mg-Al-Zn alaşımları geliştirilmiştir.
VW Beetle'nin dişli kutusu milyonlarca Mg-Si alaşımı tabakasında dökülmüştür. Günümüzde magnezyum alaşımları yalnızca ağırlık tasarrufu açısından kullanılmamakta, aynı zamanda yüksek zayıflama ile de karakterize edilmektedir. Bu, titreşime maruz kaldığında titreşimin azalmasına ve gürültü emisyonuna yol açar. Bu nedenle ayrıca magnezyum alaşımları, otomotiv endüstrisi gibi motor yapımında ilgi çekici malzemeler haline gelmiştir. Bu yüzden sadece motor parçaları magnezyum alaşımından değil, aynı zamanda motor bloklarının dökümünde de artan bir şekilde, ilk kez Alfa Romeo 156'te seri üretimde, daha sonra da BMW'de uygulanan hibrit yöntem / hibrit döküm (aynı zamanda BMW N52'e bakınız).
Kalıp dökümünde (ayrıca kalıplama bölümüne bakın), son boyutlara yakın büyük ölçekli, ince duvarlı bileşenler bile olabilir ve masraflı bir şekilde yeniden işleme tabi tutulmadan üretilebilir. Jantlar, profiller, gövdeler, kapılar, davlumbazlar, bagaj kilidi, el freni kolu ve diğerleri gibi. Sadece otomotiv endüstrisinde değil, aynı zamanda makine mühendisliğinde de Mg-Al-Zn alaşımlarının parçalarıyla yapılmıştır.
Hafif yapı için yapılan çalışmalar zaten 20’in sona ermesine yol açtı. Magnezyum-lityum alaşımlarına, lityum ilavesiyle daha hafif magnezyum alaşımlarına bile.
Tıpta magnezyum malzemeleri
Son araştırmalar, insan vücudu için emilebilir implant materyali (örneğin bir stent olarak) olarak magnezyum materyallerinin yüksek gelişim potansiyelini vaat ediyor. Magnezyum malzemeler uygulamada temas korozyonuna karşı korunmalıdır. Bununla birlikte, normal atmosferik etkilere karşı korozyon direnci iyidir. Temas korozyon davranışı, geçici sınırlı implant malzemesi olarak kullanıldığında, belirli bir süre sonra güvenli bir şekilde çözüneceği için belirleyici bir avantaj olacaktır. Bu, implant çıkarma ameliyatının risklerini ve maliyetlerini ortadan kaldırdı.
gübre
Ekilebilir ve otlak alanların sınırlandırılmasında, magnezyum oksit veya magnezyum karbonat formundaki magnezyum, tekrar bitkilerin toprağın magnezyum tükenmesini telafi etmek için kullanılır. Ayrıca, toprak pH'ı yükseltilir ve diğer besin maddelerinin mevcudiyeti iyileştirilir. Burada magnezyum bileşiği, genellikle magnezyum ve kalsiyum içeren kompleks bir gübre olarak kireç ile birlikte uygulanır. Doğal olarak Bobierrit magnezyum fosfat Mg3 (PO4) 2 (trimagnezyum fosfat) ve magnezyum nitrat olarak meydana gelen kompleks gübre olarak kullanılır.
Fizyoloji
Magnezyum, temel maddelerden biridir ve bu nedenle tüm organizmalar için vazgeçilmezdir. Bitkilerin yaprak yeşili, klorofil, magnezyum yaklaşık% 2 içerir. Orada klorofilin merkezi atomunu oluşturur. Magnezyum eksikliği olan bitkilerde, ışık yetersizliğinin yanı sıra kış uykusuna yatarlar. Ayrıca, insan vücudundaki magnezyum, magnezyum eksikliğini önlemek için günlük olarak yeterli miktarlarda sağlanmalıdır.
Bir yetişkinin gövdesi yaklaşık 20 g magnezyum içerir (karşılaştırma için: 1000 g kalsiyum). Kan plazmasında, magnezyum, proteinlerin% 40'ine bağlanır; normal serum seviyesi 0,8-1,1 mmol / l'dir. Magnezyum, bazı 300 enzim reaksiyonlarında, bir enzim bileşeni veya koenzim olarak yer alır. Ek olarak, serbest Mg iyonları hücre zarlarının potansiyelini etkiler ve bağışıklık sisteminde ikinci haberciler olarak işlev görür. Uyarılabilir kas ve sinir hücrelerinin ve otonom sinir sistemi hücrelerinin dinlenme potansiyelini stabilize ederler. Magnezyum eksikliği huzursuzluk, sinirlilik, sinirlilik, konsantrasyon eksikliği, yorgunluk, genel halsizlik hissi, baş ağrısı, kardiyak aritmi ve kas spazmlarına neden olur. Aynı zamanda kalp krizi geçirebilir. Metabolizma ve ruh alanında, magnezyum eksikliğinin depresyon ve şizofren psikozunu arttırdığı düşünülmektedir. Kandaki fazla magnezyum fazlası, aşırı alım ve böbrek fonksiyon bozukluğunun bir sonucu olarak ortaya çıkabilir ve sinir sistemi ve kalpte rahatsızlıklara yol açar.
Magnezyum emilimi ilk olarak üst ince bağırsakta değil, aynı zamanda sindirim sisteminin geri kalan kısmında da ortaya çıkar. Böbrekler tarafından atılır ve tüm gıdalarda ve içme suyunda çeşitli miktarlarda bulunur. 300 mg kadar gerekli günlük doz genellikle iyi dengelenmiş bir diyetle elde edilir. Artan bir ihtiyaç, takviyeler veya ilaçlar ile karşılanabilir. Ciddi hastalık, hamilelik veya rekabetçi sporlar nedeniyle hafif magnezyum eksikliği olasıdır. Böbrek fonksiyon bozukluğu, uzun süreli diyare, kronik bağırsak iltihabı, kötü kontrol edilen diabetes mellitus, kortikosteroidler, bazı diüretikler veya yetersiz beslenme ile alkolizmde ciddi eksiklikler ortaya çıkar.
Sitrat, glukonat, aspartat ve aspartat hidroklorür gibi magnezyum tuzları, Almanya'daki ilaçlar olarak, eksiklik durumlarına ve kas spazmları, migren veya gebelik komplikasyonları gibi nöromüsküler rahatsızlıklara karşı günlük 100 ila 400 mg dozlarında ilaç olarak onaylanmaktadır. Yan etkileri arasında gastrointestinal rahatsızlık ve ishal vardır; aşırı dozda da yorgunluk ve nabız yavaşlar. Kontrendikasyonları renal disfonksiyon ve bazı kardiyak aritmileri içerir.
Magnezyum takviyelerinin ağızdan alınması için (tabletler, çiğnenebilir veya pastiller, sıvıda çözünme granülleri) bir yandan dozaj önemlidir. Çeşitli çalışmalar, 120 mg alırken yaklaşık olarak% 35% emildiği, ancak günlük bir tam doz 360 mg alırken sadece yaklaşık% 18 emildiği sonucuna varmıştır. Vücutta emilim için, günümüzde ilaçlarda kullanılan bileşiklerin formu, farmakolojik olduğu kadar biyolojik ve klinik olarak eşdeğer oldukları için önemsizdir; Magnezyum aspartat veya magnezyum sitrat gibi organik tuzlar vücut tarafından inorganik bileşiklerden daha hızlı emilir. Öte yandan, ilave magnezyum sadece vücutta yeterli bağlayıcı molekül mevcutsa vücutta faydalı kalır; Bu, sadece magnezyum arzında uzun süreli bir artış veya en az dört hafta boyunca alımdan sonra biyokimyasal ayarlamalar ile yapılır. Magnezyum sülfat ("Epsom tuzu") daha önce müshil olarak kullanılıyordu. Magnezyum tuzları alternatif tıpta kullanılır.
Gıda
Magnezyum, 300 çeşitli proteinler, özellikle ATP ve nükleik asit bağlayıcı enzimler için bir kofaktör olarak görev yapar. İnsanlarda önerilen günlük magnezyum alımı, yaşa ve cinsiyete bağlı olarak, günde 24 ve 400 mg arasındadır.
Magnezyum, birçok gıdada, özellikle kepekli ürünlerde (örneğin kepekli ekmek, kepekli makarna, kepekli pirinç, yulaf ezmesi, mısır gevreği), maden suyu, özellikle tıbbi su, yeterli su sertliğinde musluk suyu, karaciğer, kümes hayvanları, balık, kabak çekirdeği, ayçiçeği tohumu, çikolata , Kaju fıstığı, yer fıstığı, patates, ıspanak, alabaş, meyve, portakal, muz, susam, pancar şurubu, süt ve süt ürünleri.
Tehlikeler ve koruyucu önlemler
Temel magnezyumun tehlikeleri, büyük ölçüde sıcaklığa ve parçacık boyutuna bağlıdır: kompakt magnezyum, erime noktasının altındaki sıcaklıklarda güvenliyken, magnezyumun dönüşleri ve tozları oldukça yanıcıdır. Büyük yüzey nedeniyle, ikincisi havadaki oksijenle kolayca reaksiyona girebilir. Çok ince magnezyum tozu ile kendiliğinden yanma tehlikesi vardır; Hava tozu karışımları patlayıcı bile. Balgamlaştırma genel olarak metal tozları gibi magnezyumun işlenmesinde tehlike azaltıcı bir işlemdir. Erimiş magnezyum ayrıca havada kendiliğinden tutuşur. Su ve diğer oksijen içeren bileşikler gibi birçok diğer maddelerde bile, ince taneli veya ısıtılmış magnezyum reaksiyona girer. Magnezyum erir bu nedenle atmosferik oksijen girişine karşı kalıcı koruma gerektirir. Uygulamada bu, eriyiği magnezyum klorür bakımından zengin maddelerle kaplayarak yapılır. Kükürt heksaflorür, oksidasyon koruması olarak da uygundur. Eskiden olağan sülfür kaplamaları, artık sülfür dioksitin neden olduğu güçlü rahatsızlıktan dolayı uygulanmaz.
Magnezyum yangınlarında, yaklaşık 3000 ° C'ye kadar olan sıcaklıklar ortaya çıkar. Hiçbir koşul altında magnezyum bunlarla şiddetli reaksiyona girerken su, karbondioksit, köpük veya azot gibi ortak söndürme ajanları kullanılamaz. Su bir magnezyum ateşine girdiğinde, bir oksihidrojen reaksiyonu için ciddi bir tehlike vardır.
Bir eriyik ateşi (metal yangınları) için, boğulma söndürme ilkesi, yani hızlı oksijen yer değiştirmesi uygulanır. En basit durumda kuru kumla kaplanarak, aksi takdirde magnezyum erir için bir kaplama tuzu uygulayarak. Yangın sınıfı D yangın söndürme tozu, magnezyum tozu (magnezya usta / yanmış magnezya), ayrıca kuru paslanmaz gri kastor cipsleri de uygundur.
Bu nedenle, magnezyum kullanırken, verilen tüm güvenlik talimatlarına tam olarak uyulmalıdır. Hiçbir koşulda patlayıcı bir atmosfer yaratılmamalıdır (magnezyum tozu, hidrojen, aerosoller ve yanıcı soğutma yağlayıcılarının buharları). Tutuşma kaynaklarının önlenmesi gibi normal iş güvenliği önlemleri de dikkate alınmalıdır.
kanıt
Magnezyum tespit etmenin en iyi yolu Magneson II, Titangelb veya Chinalizarin'dir.
Magneson II (4- (4-nitrofenilazo) -1-naftol) ile tespit etmek için stok madde suda çözülür ve alkalin yapılır. Daha sonra birkaç damla azo boya Magneson II çözeltisi eklenir. Magnezyum iyonlarının varlığında koyu mavi renkli bir göl oluşur. Diğer alkalin toprak metalleri daha önce karbonatlar halinde çökeltilerek uzaklaştırılmalıdır.
Titangelb (Thiazolgelb G) ile tespit için, stok madde suda çözülür ve asitlendirilir. Daha sonra bir damla Titangelb çözeltisi ile karıştırılır ve seyreltik sodyum hidroksit çözeltisi ile alkali hale getirilir. Magnezyum varlığı parlak kırmızı bir çökelti oluşturur. Nikel, çinko, manganez ve kobalt iyonları bu saptamaya müdahale eder ve ilk önce sülfür şeklinde çökeltilmelidir.
Quinalizarin ile tespit için, asit numune çözeltisi iki damla boya çözeltisi ile karıştırılır. Daha sonra bazik reaksiyona kadar seyreltilmiş sodyum hidroksit çözeltisi eklenir. Mavi bir leke veya çökelti, magnezyum gösterir.
Magnezyum tuzları için bir tespit reaksiyonu ve çökeltilerin oluşumu fosfat tuzu çözeltileri ile birlikte kullanılabilir. Amonyak ve amonyum klorür ile pH 8 ila 9 tamponlu numune çözeltisine kadar ağır metal içermeyen, buna disodyum hidrojen fosfat çözeltisi ile eklenir. Magnezyum amonyum fosfat MgNH4PO4'e bağlı beyaz, asitte çözünür bir bulanıklık, magnezyum iyonlarını gösterir:
Amonyak çözeltisinden Mg2 + ayrıca, az çözünür sarı-yeşilimsi bir bileşik olarak oksin ile de tespit edilebilir. Bu kanıt katyon ayırma işlemi için uygundur.
Bağlantıları
Bileşiklerde, magnezyum hemen hemen yalnızca 2 oksidasyon durumuyla çift değerli bir katyon olarak ortaya çıkar.
Oksitler ve hidroksit
Magnezyum oksit (magnezya), sodyum klorür yapısında renksiz kristaller oluşturur. Doğada, volkanik mineral perikülleri olarak oluşur. Bunlar beyazdan griye, kapanımlardan da koyu yeşil, parlak camsı normal kristallerdir. Gıdalara asitlik düzenleyici veya salma maddesi olarak eklenir ve ayrıca laboratuvarlarda ve endüstride çeşitli mühendislik uygulamalarına sahiptir. Tıpta ikame tedavisi için kullanılır.
Magnezyum hidroksit, doğal olarak bir mineral bursit olarak oluşan renksiz, kuvvetli bazik bir tuzdur. P3m1 (164 oda grubu) alan grubunda bir trigonal kristal yapısına sahiptir ve yemeklik yağ katkı maddesi olarak (sülfür dioksitin ayarlanması için), atıksu arıtımı için bir topaklaştırıcı olarak, termoplastiklerde alev geciktirici olarak (temizlik malzemesinde poliolefin, polivinil klorür) ve elaserde bir katkı maddesi olarak kullanılır. kullandı. Tıpta, mide asidinin nötralizasyonu için bir antasit olarak ve hafif bir müshil olarak kullanılır.
Magnezyum peroksit, Pa3 uzay grubunda pirit kristal yapıya sahip, ince toz haline getirilmiş, renksiz bir bileşiktir (alan grup numarası 205). Kalsiyum peroksit benzer ve sulu çözeltilerle kontrollü reaksiyon yaparak oksijeni serbest bırakır. Tarım, eczacılık ve kozmetik alanlarında çeşitli uygulamalara sahiptir.
halidler
Magnezyum klorür oldukça higroskopiktir ve doğal olarak mineral bishopitte (MgCl2 · 6 H2O), çift tuzlu karnallit (KMgCl3 · 6 H2O), deniz suyu ve tuz göllerinde oluşur. R3m uzay grubundaki trigonal kristal sisteminde kristalleşir (uzay grup numarası 166). Gıda teknolojisinde, asitlik düzenleyici, birleştirici, lezzet arttırıcı, taşıyıcı veya salıcı madde olarak kullanılır. Magnezyum klorür hekzahidrat, termal bir batarya olarak, ısı enerjisini depolayabilir ve serbest bırakabilir.
Magnezyum florür, P42 / mnm (grup grup numarası 136) uzay grubundaki rutil yapı içinde dörtgen olarak kristalleşen renksiz kristaller oluşturur. Optik özellikleri ve kimyasal stabilitesi, optik uygulamalar için önemli bir malzeme olmasını sağlar.
Magnezyum bromür ve magnezyum iyodür ayrıca P3m1 (grup grubu numarası 164) uzay grubunda trigonal bir kristal yapıya sahip higroskopik tuzlardır.
Diğer inorganik bileşikler
Magnezyum karbonat doğada manyezit (bitterpar) kadar büyük miktarlarda bulunur. R3c uzay grubunda trigonal kristalleşir (167 uzay grubu). Gıda endüstrisinde, bir asitlik düzenleyici, taşıyıcı veya salıcı madde olarak eklenir. Tırmanma ve jimnastik için kullanılır ve ayrıca Magnesia ve Chalk olarak da bilinir. Sporcular daha sonra antrenmana başlamadan önce kendilerini avuç içlerinde kuruturlar; böylece barlar veya yatay çubuk veya halterin demir çubukları tutulurken derileri çok sıkı yapışmaz. Aynı zamanda tıbbi ve endüstriyel uygulamaları vardır.
Magnezyum nitrat, suda kolayca çözünür, renksiz, higroskopik bir tuzdur. Heksahidrat (Mg (NO3) 2.6 H2O), P21 / c (grup grup numarası 14) alan grubuyla monoklinik bir kristal yapıya sahiptir. Gübre, gizli ısı deposu (heksahidrat olarak) veya seramik endüstrisinde kullanılır.
Magnezyum sülfat heptahidrat (Mg (SO4) · 7 H2O) Mineral Epsomit olarak bilinir. Eşkenar dörtgen bir psödotragonal kristal kafes oluşturan renksiz kristaller oluşturur. Kristaller genellikle lifli agregatlarda çiçek açar ve sarkıtlar oluşturur. Gübreler için, kurutma maddesi olarak ve tıbbi uygulamalarda kullanılır.
Endüstride magnezyum fosfatlar (magnezyum dihidrojen fosfat (Mg (H2PO4) 2), magnezyum hidrojen fosfat (MgHPO4) ve magnezyum fosfat (Mg3) (PO4) 2)) sanayi reçinesi olarak kullanılır. Gıda endüstrisinde, yem katkı maddesi, müshil ve yiyecek katkı maddesi olarak kullanılırlar. Yiyecekler asitlik düzenleyici veya serbest bırakma maddesi olarak eklenir.
Spinel, ideal bir kimyasal bileşim olan MgAl2O4 ile oksitlerin ve hidroksitlerin mineral sınıfından sıkça oluşan bir mineraldir ve bu nedenle kimyasal olarak bir magnezyum alüminattır. Fd3m uzay grubundaki kübik kristal sistemindeki manyetit ile izotipik olarak kristalleşir (227 uzay grubu numarası).
Dolomit, CaMg [CO3] 2 kimyasal bileşimine sahip karbonatların ve nitratların mineral sınıfından çok yaygın bir mineraldir ve bu nedenle kimyasal olarak bir kalsiyum-magnezyum karbonattır. R3 uzay grubundaki trigonal kristal sisteminde kristalleşir (alan grup numarası 148).
Magnezyum hidrit, hidrojen ve enerji depolaması olarak kullanılabilir. Magnezyum hidrürden salınan hidrojen, sudan daha hafif, ilginç özelliklere sahip metal bir köpük üretebilir.
Diğer ilginç kristalimsi magnezyum bileşikleri, örneğin, magnezyum diborid, magnezyum karbid, magnezyum nitrür, magnezyum sülfit, magnezyum silisit, magnezyum almanit, magnezyum metasilikat, magnezyum titanyum oksit ve magnezyum polonidini içerir.
organomagnezyum
Magnezyum organilleri, magnezyum ve karbon arasında bir bağın mevcut olduğu organometalik bileşiklerdir. Organomagnezyum arasında Grignard bileşikleri (R-Mg-X) en önemlisidir. İkili magnezyum organilleri ve alkenilmagnezyum halojenürler, önemli ölçüde alt rol oynamaktadır.
Organylmagnesiumhalogenide
Organilmagnezyum halojenürler (genellikle Grignard bileşiği olarak adlandırılır), organil halojenürlerin magnezyum dönüşleriyle reaksiyona sokulmasıyla doğrudan bir işlemde elde edilir. Grignard bileşikleri, Schlenk dengesinde çözelti içindedir. Halojen-organil ikamesi altında temel organillere reaksiyona girerler:
Genel:
z. Örneğin:
veya çoklu bağ sistemli organillerin eklenmesi ile:
Genel:
z. B.:
İkili magnezyum organilleri (magnezyum diorganiller olarak da adlandırılan R2Mg) çeşitli şekillerde üretilebilir:
transmetalasyon ile, örneğin cıva diorganilen:
1,4-dioksan yardımı ile Schlenk dengesinin kaymasındaki değişme ile:
Magnesacycles (halkada bir magnezyum bulunan siklik alkanlar), 1,4 dioksan ile de hazırlanabilir.
Grignard bileşiklerinin lityum organillerle metatezi ile
hidromanyetikleştirme ile (2-alkenlere MgH1 eklenmesi):
1,3-bütadien veya antrasen gibi bazı doymamış hidrokarbonlarda C = C çift bağlarına element magnezyum ilavesiyle (metal ekleme). Örneğin, oda sıcaklığında tetrahidrofuran içerisinde 1,3-butadien reaksiyonu mümkündür:

Aynı zamanda (2-buten-1,4-diil) magnezyum olarak da adlandırılan üretilen magnezyum bütadien, başka sentezlerde bir bütadien anyon kaynağı olarak işlev görebilir. Benzer şekilde, turuncu-sarı magnezyum antrasen gösterilmiştir. Magnezyum antrasen daha sonra magnezyumun hidrojenlenmesi için bir katalizör olarak kullanılabilir.
alkenylmagnesium
Alkinler, sözde karbomagnesasyon sırasında alkenilmagnezyum halojenürler vermek üzere alkenlerle reaksiyona girerler:

Diğer organik bileşikler
Magnezyum hidrojen sitrat ve trimagnezyum dikratrat, sitrik asidin magnezyum tuzlarıdır. Magnezyum sitrat ilaç olarak kullanılır.
Magnezyum monoperoksiftalat, yüzey dezenfeksiyonu için bir dezenfektandır.
Magnezyum stearat, stearik asidin magnezyum tuzudur ve kireç sabunlarına aittir. Bir magnezyum iyonu ve iki uzun zincirli stearat iyonundan oluşur.
Magnezyum fiyatı
Magnezyum fiyatları -> stratejik metal fiyatları
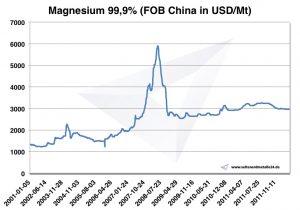
Grafik Magnezyum 2001-2011













