Sodyum, Na, atom numarası 11
Sodyum Fiyatı, Oluşumu, Ekstraksiyonu ve Kullanımı
Sodyum, simgesi Na ve atom numarası 11 olan, sıklıkla oluşan bir kimyasal elementtir. Elementlerin periyodik tablosunda 3. periyotta ve alkali metal olarak 1. IUPAC grubunda veya 1. ana grupta yer alır. Sodyum, tek kararlı izotopu 23Na olan saf bir elementtir.
 Elemental sodyum ilk olarak 1807'de Humphry Davy tarafından sodyum hidroksitten kaynaşmış tuz elektrolizi ile elde edildi ve sodyum olarak adlandırıldı. Bu adlandırma, İngilizce ve Fransızca dil alanlarında, türevleri Romantizmde ve kısmen de Slav dillerinde kullanılmaktadır. Almanca sodyum adı, Mısır netjerjinden Arapça نطرون, DMG naṭrūn, Natron'dan türetilmiştir. Sodyum ve türevleri, Almanca dışında İskandinavya, Hollandaca ve bazı Slav dillerinde kullanılmaktadır. Japonca'da sodyumun kulağa Almanca gelen Japonca adı vardır ナ ト リ ウ ム Natoriumu.
Elemental sodyum ilk olarak 1807'de Humphry Davy tarafından sodyum hidroksitten kaynaşmış tuz elektrolizi ile elde edildi ve sodyum olarak adlandırıldı. Bu adlandırma, İngilizce ve Fransızca dil alanlarında, türevleri Romantizmde ve kısmen de Slav dillerinde kullanılmaktadır. Almanca sodyum adı, Mısır netjerjinden Arapça نطرون, DMG naṭrūn, Natron'dan türetilmiştir. Sodyum ve türevleri, Almanca dışında İskandinavya, Hollandaca ve bazı Slav dillerinde kullanılmaktadır. Japonca'da sodyumun kulağa Almanca gelen Japonca adı vardır ナ ト リ ウ ム Natoriumu.
Normal koşullar altında, sodyum mumsu, gümüşi, oldukça reaktif bir metaldir. Güçlü reaktivitesi nedeniyle, metalik (elemental) sodyum, inert koşullar altında, çoğunlukla parafin yağında veya petrolde, daha büyük miktarlarda hava geçirmez çelik varillerde depolanır.
Sodyum, yer kabuğundaki en yaygın on elementten biridir ve yerkabuğundaki çok sayıda mineralde bulunur. Deniz suyu, sodyum iyonları şeklinde önemli miktarda sodyum içerir.
Tarih
Antik çağda, Mısırlılar soda göllerinden elde edilen soda için netjerj (neter) terimini kullandılar. Yunanlılar bu kelimeyi Yunanca νίτρον nitron, Romalılar nitrium, Araplar natrun olarak benimsediler. Temel metalin aksine, sodyum bileşikleri uzun zamandır bilinmektedir ve o zamandan beri deniz suyundan veya göllerden çıkarılmakta, yeraltı yataklarından çıkarılmakta ve ticareti yapılmaktadır. En önemli sodyum bileşiği olan sofra tuzu (sodyum klorür), madenlerde veya deniz suyu veya tuzlu kaynak suyunun tuz tavalarında kurutulmasıyla elde edilirdi. Tuz ticareti birçok şehir için zenginliklerinin temeliydi ve bazı durumlarda adlarını bile şekillendirdi (Salzgitter, Salzburg). Hallstatt, Hallein, Halle (Saale), Bad Hall, Bad Reichenhall, Schwäbisch Hall, Schweizerhalle veya Tirol'deki Hall gibi yer adları, Saline (Hall) için Germen ismine atıfta bulunur. Sodyum karbonat (soda veya kabartma tozu) ve sodyum nitrat gibi doğal olarak oluşan diğer sodyum bileşikleri de eski zamanlardan beri çıkarılmış ve ticareti yapılmıştır.
Elementel sodyum üretimi ancak 1807'de Humphry Davy'de, bir güç kaynağı olarak voltaik kolonlar kullanılarak erimiş sodyum hidroksitin (kostik soda) elektrolizi ile başarılı oldu. 19 Kasım 1807'de Londra'daki Royal Society'ye bildirdiği üzere, iki farklı metal kazandı: Soda sodyumun içerdiği sodyuma, Fransızca ve İngilizce konuşulan ülkelerde hala kullanılan addır; diğer metale potasyum adını verdi. 1811'de Berzelius, mevcut sodyum adını önerdi.
Bulunduğu
 Evrende sodyum, kalsiyum ve nikel ile karşılaştırılabilir frekansta 14. sıradadır. Sarı sodyum D çizgisi, güneş de dahil olmak üzere birçok gök cismi tarafından yayılan ışıkta kolayca tespit edilebilir.
Evrende sodyum, kalsiyum ve nikel ile karşılaştırılabilir frekansta 14. sıradadır. Sarı sodyum D çizgisi, güneş de dahil olmak üzere birçok gök cismi tarafından yayılan ışıkta kolayca tespit edilebilir.
Sodyum, yerkabuğunun %2,36'sını oluşturan, yeryüzünde en bol bulunan altıncı elementtir. Reaktivitesinden dolayı elementel halde değil, her zaman bileşiklerde, sodyum tuzlarında bulunur. Deniz suyu harika bir sodyum deposudur. Bir litre deniz suyunda ortalama 11 gram sodyum iyonu bulunur.
Yaygın sodyum mineralleri albit (soda feldispat olarak adlandırılır), NaAlSi3O8 ve oligoklaz (Na, Ca) Al (Si, Al) 3O8'dir. Feldispatların bir parçası olan bu kaya oluşturan minerallere ek olarak, büyük tuz birikintilerinde sodyum oluşur. Her şeyden önce, denizin bazı kısımlarının kurumasından kaynaklanan büyük halit birikintileri (sodyum klorür, halk arasında genellikle kaya tuzu olarak adlandırılır) vardır. Bunlar, sodyum ve bileşiklerinin ekstraksiyonu için en önemli kaynağı temsil eder.İyi bilinen Alman tuz üretim yerleri arasında Salzgitter, Bad Reichenhall, Stade ve Bad Friedrichshall bulunmaktadır.
Yaygın sodyum klorüre ek olarak, doğada başka bileşikler de bulunur. Sodyum nitrat veya sodyum nitrat (Şili nitratı da denir) NaNO3, birkaç doğal nitrat mineralinden biridir. Sudaki iyi çözünürlüğü nedeniyle, Şili'deki Atacama Çölü gibi yalnızca özellikle kuru alanlarda bulunur. Haber-Bosch prosesi icat edilmeden önce bu, birçok gübre ve patlayıcı için en önemli hammaddeydi.
Sodyum karbonat Na2CO3 ayrıca çeşitli minerallerde doğal olarak bulunur. En iyi bilinen mineral soda Na2CO3 · 10 H2O'dur. Büyük miktarlarda çıkarılır ve esas olarak cam üretiminde kullanılır.
Ayrıca çok sayıda başka sodyum minerali de vardır (ayrıca bakınız: Kategori: Sodyum Mineralleri). İyi bilinen bir tanesi kriyolittir (buz taşı, Na3 [AlF6]), erimiş halde alüminyum üretiminde alüminyum oksit için bir çözücü görevi görür. Bilinen tek kriyolit yatağı Grönland'da çıkarıldığından, kriyolit yapay olarak üretilir.
Çıkarma ve sunum

Büyük ölçekli sodyum üretimi, Downs hücresinde (1924'te James C. Downs tarafından patentli) kuru sodyum klorürün kaynaşmış tuz elektrolizi ile gerçekleştirilir. Erime noktasını düşürmek için 60 °C'de eriyen %40 kalsiyum klorür ve %580 sodyum klorürden oluşan bir ötektik tuz karışımı kullanılır. Bir katkı maddesi olarak baryum klorür de mümkündür. Yaklaşık yedi voltluk bir voltaj uygulanır. Bir kilogram sodyum üretmek için elektroliz sırasında yaklaşık 10 kWh ve tüm üretim sürecinde yaklaşık 12 kWh elektrik kullanılır.
Katotta sodyum oluşumu
Anotta klor oluşumu
Genel yanıt
Silindirik elektroliz hücresi, merkezi bir grafit anot ve demirden yapılmış bir yan katot halkasından oluşur. Hücrenin üzerinde oluşan kloru toplayan ve boşaltan bir çan bulunur. Sodyum katotların üzerinde toplanır ve soğutulmuş bir yükseltici boru vasıtasıyla hücreden çıkarılır. Oluşan kalsiyum da orada kristalleşir ve eriyiğe geri döner.
Sodyum klorürün elektrolizi, Castner işleminin yerini aldı. Sodyum, sodyum hidroksitin kaynaşmış tuz elektrolizi ile elde edildi. Bu, sodyum hidroksitin (318 ° C) daha düşük erime noktası avantajına sahipti, ancak daha fazla elektrik enerjisi gerekiyor. Klor-alkali erimiş tuz elektrolizinin piyasaya sürülmesinden bu yana, sodyum fiyatı önemli ölçüde düştü. Hacim açısından sodyum, bu nedenle en ucuz hafif metaldir. Ancak fiyat, büyük ölçüde elektrik maliyetlerine ve ayrıca üretilen klorun fiyatına bağlıdır.
Fiziksel özellikleri
 Sodyum gümüşi beyaz, yumuşak hafif bir metaldir. Birçok özelliğinde lityum ve potasyum arasında yer alır. 97,82 °C'lik erime noktası, lityumun (180,54 °C) ile potasyumun (63,6 °C) erime noktası arasındadır. Bu, kaynama noktası ve özgül ısı kapasitesi ile benzerdir. 0,968 g · cm − 3 yoğunluğu ile sodyum, özellikle en hafif elementlerden biridir. Oda sıcaklığında katı olan elementlerden sadece lityum ve potasyum daha düşük yoğunluğa sahiptir. 0,5 Mohs sertliği ile sodyum, bıçakla kesilebilecek kadar yumuşaktır.
Sodyum gümüşi beyaz, yumuşak hafif bir metaldir. Birçok özelliğinde lityum ve potasyum arasında yer alır. 97,82 °C'lik erime noktası, lityumun (180,54 °C) ile potasyumun (63,6 °C) erime noktası arasındadır. Bu, kaynama noktası ve özgül ısı kapasitesi ile benzerdir. 0,968 g · cm − 3 yoğunluğu ile sodyum, özellikle en hafif elementlerden biridir. Oda sıcaklığında katı olan elementlerden sadece lityum ve potasyum daha düşük yoğunluğa sahiptir. 0,5 Mohs sertliği ile sodyum, bıçakla kesilebilecek kadar yumuşaktır.
Diğer alkali metaller gibi, sodyum da Im3m uzay grubu (uzay grubu no. 229) ve birim hücre başına iki formül birimi ile vücut merkezli bir kafes içinde kübik kristal sisteminde kristalleşir. 51 K'nin altında, a = 376 pm ve c = 615 pm kafes parametreleriyle altıgen en yakın küre paketine dönüşür.
Sodyum buharı hem bireysel metal atomlarından hem de Na2 formundaki dimerlerden oluşur. Kaynama noktasında atomların %16'sı dimer formundadır. Buhar sarıdır ve bakıldığında mor görünür.
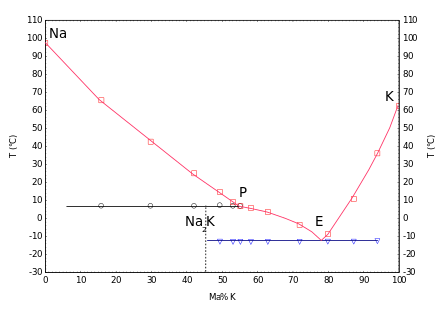
Potasyum ile oda sıcaklığında çok çeşitli konsantrasyonlarda sıvı karışımlar oluşur. Faz diyagramı, 7 ° C'de uyumsuz bir eriyen Na2K bileşiğini ve %12,6'lik bir potasyum içeriği (kütle oranı) ile -77 ° C'de bir ötektik gösterir.
Kimyasal özellikleri
 Diğer alkali metaller gibi, sodyum da çok temel bir elementtir (normal potansiyel: -2,71 V) ve diğer birçok elementle ve bazen bileşiklerle kolayca reaksiyona girer. Reaksiyonlar özellikle klor veya kükürt gibi metal olmayanlarla şiddetlidir ve parlak sarı bir alevle meydana gelir.
Diğer alkali metaller gibi, sodyum da çok temel bir elementtir (normal potansiyel: -2,71 V) ve diğer birçok elementle ve bazen bileşiklerle kolayca reaksiyona girer. Reaksiyonlar özellikle klor veya kükürt gibi metal olmayanlarla şiddetlidir ve parlak sarı bir alevle meydana gelir.
Aksi takdirde reaktif oksijen bir uzmanlık alanıdır.Sodyum ve oksijen, oda sıcaklığında veya ısıtıldıklarında su olmadan birbirleriyle doğrudan reaksiyona girmezler. Tamamen susuz bir oksijen atmosferinde, sodyum reaksiyona girmeden bile eritilebilir. Öte yandan, eser miktarda nem varsa, sodyum peroksit oluşturmak üzere kolayca yanar.
Sodyumun oksijenle reaksiyonu
Sodyumun su ile kuvvetli ekzotermik reaksiyonu
 Sodyum, sodyum hidroksit oluşturmak için su ile reaksiyona girerek hidrojen oluşturur. Alkali metallerin su ile reaksiyonunun yüksek hızlı kayıtları, bir Coulomb patlamasını düşündürür.
Sodyum, sodyum hidroksit oluşturmak için su ile reaksiyona girerek hidrojen oluşturur. Alkali metallerin su ile reaksiyonunun yüksek hızlı kayıtları, bir Coulomb patlamasını düşündürür.
Sodyumun su ile reaksiyonu
Alkollerde sodyum, hidrojen oluşumu ile sodyum alkolatlara dönüştürülür. Genellikle yüksek reaksiyon ısısı nedeniyle erir. Sodyum ince bir şekilde dağılmışsa ve sonuçta ortaya çıkan geniş reaksiyon yüzey alanıysa, reaksiyon patlayıcı olabilir ve hidrojeni tutuşturabilir.
Sodyumun etanol ile reaksiyonu
Sodyum, diklorometan, kloroform, karbon tetraklorür gibi klorlu bileşiklerle temas ederse, sodyum klorür oluşumu ile hızlı ve ekzotermik bir reaksiyon meydana gelir.
Sıvı amonyak içinde çözünmüş sodyum
Sodyum, sıvı amonyak içinde mavi renkle çözünür. Renk, sodyum tarafından çözeltiye salınan serbest elektronlara dayanmaktadır. Çözelti ayrıca elektrik akımı iletir ve seyreltilmiş paramanyetiktir. Sodyumun anyonu, örneğin potasyum (2.2.2-kriptand) natrür (K + (C222) Na−) formundaki sodyum iyonu benzer şekilde temsil edilebilir. Çok güçlü bir indirgeyici ajandır.
izotop
Sodyum için toplam 19 izotop ve 3Na'dan 18Na'ya kadar 37 çekirdek izomeri bilinmektedir. Bunlardan sadece biri doğal olarak oluşur, izotop 23Na. Bu, sodyumu 22 saf elementten biri yapar. En uzun ömürlü yapay izotoplar, beta artı bozunma (β +) altında 22 yıllık bir yarı ömürle 2,602Ne'ye dönüşen 22Na ve beta bozunması altında 24 saatlik bir yarı ömürle 14,957Mg'ye bozunan 24Na'dır. Bunlar nükleer tıpta izleyici olarak kullanılır. 22Na, magnezyum veya alüminyum hedeflerin birkaç hafta boyunca bir siklotrondan protonlarla ışınlanmasıyla üretilebilir.
Diğer tüm izotoplar ve izomerler, yalnızca saniye veya milisaniyelik kısa yarı ömürlere sahiptir.
Kullanım

Sodyum en yaygın kullanılan alkali metaldir. Hem teknik olarak hem de laboratuvarda çeşitli amaçlarla kullanılmaktadır. Okul derslerinde ve deneysel derslerde sodyum kaşık ve su yardımıyla hidrojen üretmek için sodyum kullanılabilir. Sodyumdan bazı sodyum bileşikleri yapılır. Bunlar, örneğin ağartma maddesi olarak kullanılan sodyum peroksit ve güçlü baz sodyum amiddir. Bunlar doğal olarak oluşmazlar ve doğrudan sodyum klorürden elde edilemezler. Sodyum siyanür ve sodyum hidrit sodyumdan yapılır. Sodyum, katılaşma yapısını etkilediğinden, alüminyum-silikon alaşımlarına ilave olarak kullanılabilir (Aladár Pácz'a göre arıtma işlemi).
Katalizatör
Sodyum, 1,3-bütadien ve izoprenin polimerizasyonunu katalize eder. Bu nedenle suni kauçuk üretiminde kullanılmıştır. Buna olarak bilinen, katalizör olarak sodyum kullanılarak yapılan plastik, dünyanın ilk insan yapımı kauçuğuydu. 1937'den itibaren Schkopau'daki Buna (bütadien ve sodyumdan sonra adlandırılan) fabrikalarında üretildi.
Soğutucu
Çelikten (140 ila 15 W / (m · K) çok daha yüksek olan 58 W / (m · K) ısıl iletkenliğe sahip sodyum, iyi ısı transfer özelliklerine ve ayrıca büyük bir düşük erime noktasına sahiptir. sıvı aralığı aynı zamanda yüksek termal yüklere maruz kalan içten yanmalı motorlarda egzoz valflerini soğutmak için soğutucu olarak kullanılır. Bu amaçla, valf gövdeleri içi boş ve kısmen sodyum ile doldurulmuş yapılır. Çalışma sırasında, sodyum erir ve sıcak ve soğuk taraflar arasında ileri geri sallanır. Isı, kızgın valf diskinden uzağa taşınır.
Hızlı yetiştiriciler erimiş sodyum ile soğutulur. Bu tür damızlık reaktörlerde, nükleer fisyon sırasında üretilen hızlı nötronlar, diğer reaktör tiplerinde olduğu gibi yakıt çubukları arasında yavaşlatılmamalıdır. Bu nedenle frenleme ajanı (moderatör) görevi gören su soğutma için kullanılmamalıdır. Daha sonra ısı, ikincil bir sodyum devresi aracılığıyla türbin çalışması için buhar jeneratörüne iletilir.
Işık üretimi
Sodyum buharlı lambalar, elektrik boşalması sırasında sodyum buharının yaydığı karakteristik sarı ışığı kullanır. Yüksek ışık verimliliği nedeniyle, genellikle sokak aydınlatması için kullanılırlar.
İndirgen madde
Titanyum, zirkonyum, tantal veya uranyum gibi bazı metaller, kararlı ve ayrılamaz karbürler oluştuğundan karbon ile indirgeme yoluyla elde edilemez. Diğer bazı elementlere, özellikle alüminyum ve magnezyuma ek olarak, sodyum bu nedenle indirgeyici madde olarak kullanılır. Sodyumun yapımında kullanılan bir diğer element ise potasyumdur. Potasyum çok baz bir element olduğu için karbonla indirgenerek elde edilemez. Elektroliz ile teorik olarak mümkün bir üretim, potasyumun bir potasyum klorür eriyiği içinde iyi çözünürlüğünden dolayı teknik olarak mümkün değildir.
Sodyum, organik sentezde indirgeyici ajan olarak önemli bir rol oynar. Uzun bir süre boyunca, en önemli teknik sodyum uygulaması, kloroetandan tetraetil kurşun üretimiydi. Bu, benzine eklenen önemli bir vuruntu önleyici maddeydi. Çevresel nedenlerle, tetraetil kurşun kullanımı ciddi şekilde kısıtlanmış veya tamamen yasaklanmıştır. Bu nedenle sodyum tüketimi azaldı. Aksi takdirde, Huş ağacı indirgeme ve pinakol birleştirme gibi diğer reaksiyonlarda sodyum kullanılır. Bununla birlikte, bunlar laboratuvar ölçeğinde daha fazla ilgi görmektedir.
kurutucu
Sodyum eser miktarda suyla da reaksiyona girdiğinden, dietil eter veya toluen gibi organik çözücüleri kurutmak için taze preslenmiş sodyum teli kullanılabilir. Bu yöntem, klor atomu ile şiddetli reaksiyon nedeniyle halojen içeren çözücüler (örnek: metilen klorür, kloroform) için uygun değildir.
Sodyum-potasyum alaşımları oda sıcaklığında sıvı haldedir. Bunlar, organik sentezde ısı transferi ve halojensizleştirme için kullanılır. Na-K, özellikle düşük artık su içeriği elde etmek için önceden kurutulmuş bazı çözücülerin kurutulması için çok uygundur.
Elektrik iletkeni
1960'larda polietilen kılıflı sodyum kablolar denendi. Düşük iletkenlik nedeniyle, varsayımsal bir sodyum kablosunun çapı %75 daha büyük olacaktır.
kanıt
 Niteliksel saptama ve niceliksel belirleme, alevin yoğun sarı rengi aracılığıyla atomik spektroskopi ile veya daha kesin olarak, 588,99 nm ve 589,59 nm'de çift Na hattı aracılığıyla gerçekleştirilir.
Niteliksel saptama ve niceliksel belirleme, alevin yoğun sarı rengi aracılığıyla atomik spektroskopi ile veya daha kesin olarak, 588,99 nm ve 589,59 nm'de çift Na hattı aracılığıyla gerçekleştirilir.
Sodyumun tamamen kimyasal yolla tespiti çok zordur. Hemen hemen tüm sodyum bileşikleri suda kolayca çözünür olduğundan, klasik çökeltme reaksiyonları ve gravimetrik belirlemeler pek mümkün değildir. İstisnalar, her ikisi de az çözünür olan sarı sodyum magnezyum uranil asetat NaMg (UO2) 3 (CH3COO) 9 · 9 H2O ve renksiz sodyum heksahidroksoantimonat Na [Sb (OH) 6]'dır. Sülfat-bizmut çift tuzu 3Na2SO4 · 2Bi2 (SO4) 3 · 2H2O ile bir çökeltme reaksiyonu mümkündür. Sodyum iyonları sulu çözeltide renksiz olduğundan renk reaksiyonları nadiren gerçekleşir. Bu nedenle iyon kromatografiden ayrı olarak sadece spektroskopik yöntemler pratik öneme sahiptir.
Fizyoloji
Sodyum, tüm hayvan organizmaları için gerekli olan elementlerden biridir. Hayvan organizmasında sodyum - klorla birlikte - en yaygın dokuzuncu elementtir ve kalsiyum ve potasyumdan sonra en yaygın üçüncü inorganik iyondur. Fizyolojik olarak bu nedenle kitle unsurlarından biridir. Sodyum canlılarda Na+ iyonları şeklinde bulunur.
Ortalama 70 kg vücut ağırlığı olan insan vücudu, Na + iyonları halinde yaklaşık 100 g sodyum içerir. Bunun üçte ikisi NaCl ve üçte biri NaHCO3 olarak mevcuttur. İnsan vücudundaki hücre dışı elektrolitlerin %90'ını oluşturduğu için sodyum konsantrasyonu damar hacmi aracılığıyla hücreler arası sıvının hacmini belirler.
Önerilen ve Gerçek Sodyum Alımları
DA-CH referans değerlerine göre yetişkinler için minimum sodyum alımı için tahmini değer 550 mg/gün'dür. Bununla birlikte, çeşitli kuruluşlar özellikle maksimum sodyum alımı için önerilerde bulunmuştur (WHO: 2 g/gün; AHA: 1,5 g/gün).
Gerçek günlük sodyum alımı genellikle bu değerlerin üzerindedir. Bunun nedeni nispeten yüksek tuz tüketimimizdir (2,5 gr tuz yaklaşık 1 gr sodyum içerir). Sodyum tüketiminin anketler kullanılarak belirlendiği Max Rubner Enstitüsü'nün Ulusal Tüketim Çalışması II (NVS II), ortalama 3,2 g / gün (erkek) ve 2,4 g / gün (kadın) alımı gösterdi. Anketler yoluyla yapılan kayıtlar hatalara açık olduğundan, gerçek sodyum alımı muhtemelen daha da yüksektir. 24 saatlik idrarda sodyum tayini, sodyum alımını belirlemek için altın standart olarak hizmet eder. DSÖ tarafından hazırlanan bir rapora göre, Almanya'nın çeşitli yerlerinde INTERSALT çalışmasında sodyum atılımı günde 4,1–4,5 g (erkek) ve 2,7–3,5 g/gün (kadın) olmuştur.
Sodyum dengesinin düzenlenmesi
Sodyum içeriği sıkı bir şekilde kontrol edilir ve su dengesinin düzenlenmesi ile yakından ilgilidir. Serumdaki normal sodyum konsantrasyonu 135-145 mmol/l civarındadır. Sodyum seviyesi düşükse, hücre hacminde bir artışın olduğu hiponatremi olarak adlandırılır. Hipernatremide ise sodyum seviyesi çok yüksektir ve hücreler küçülür. Her iki durumda da asıl bozukluk beynin işleyişidir. Epileptik nöbetlere ve komaya kadar giden bilinç bozukluklarına yol açabilir. Renin-anjiyotensin-aldosteron sistemi, adiüretin ve atriopeptin, regülasyonda önemli bir rol oynar.
Sodyumun düzenlenmesinde anahtar organ böbrektir. Bu, vücuttaki sodyumu seyreltmek ve sodyumun kendisini atmak için fazla sodyum olması durumunda suyu tutmaktan sorumludur. Sodyum eksikliği varsa daha fazla su atılır ve sodyum tutulur. Bununla birlikte, böbreklerin değişen sodyum seviyesine tepki verebilmesi için biraz zamana ihtiyacı olduğu belirtilmelidir.
Hücrelerdeki dağılım
Na + iyonları organizmada eşit olarak dağılmamıştır, aksine diğer iyonlarda olduğu gibi hücre içindeki ve dışındaki konsantrasyonlar çok farklıdır. Na + - ve Cl− (esas olarak dış), K + - ve organik anyonların (esas olarak iç) bu konsantrasyon gradyanları, canlı hücrelerin zar potansiyelinin çoğunu belirler. Bu zar potansiyeli ve iyon gradyanları çoğu hücre için hayati öneme sahiptir. Küçük inorganik iyonlar, konsantrasyon farklılıkları nedeniyle sürekli olarak komşu alana göç ettiğinden, buna karşı koymak için aktif bir işlem gereklidir. En önemli rol, enerji tüketirken Na + ve K + iyonlarını tekrar tekrar pompalayan sodyum-potasyum pompası tarafından oynanır.
Sinir hücrelerindeki fonksiyonlar
Na + iyonları, sinir hücrelerinde (ve kas liflerinde) uyarıların oluşmasında ve iletilmesinde önemli bir rol oynar. Sinir hücrelerinin postsinapslarında (ve kas liflerinin nöromüsküler uç plakasında), uyarıldığında önceki sinir hücresi tarafından salınan nörotransmiterler tarafından aktive edildikten sonra, açılan ve sodyum iyonlarına karşı geçirgen hale gelen belirli reseptörler vardır. Sodyum akışı, hücrenin zar potansiyelinde, temel durumda kararlı olan yerel bir değişikliğe neden olur. İçi dışarıya göre daha az olumsuz hale gelir, buna depolarizasyon denir. Bu depolarizasyon akson yolunda hala yeterince güçlüyse, başka bir tür sodyum kanalı açılır. Bunlar, lokal depolarizasyonu - diğer iyon kanallarıyla birlikte - belirli bir açılma ve kapanma ritmi ile ileten, aksonun voltaja bağlı sodyum kanallarıdır. Sinir hücrelerinin aksonlarında sürekli bir voltaj dalgası, aksiyon potansiyeli yaratılır. Sodyum-potasyum pompası, temel durumu geri kazanmada önemli bir rol oynar.
Bitkilerde sodyum
Ancak bitkilerde sodyum ikincil bir rol oynar. Potasyum tüm bitkiler ve çoğu mikroorganizma için gerekliyken, sodyum yalnızca bazı C4 ve CAM bitkileri için gereklidir, ancak genellikle C3 bitkileri için gerekli değildir. Ancak lokasyona bağlı olarak sodyum alımından yararlanabilecek bitkiler bundan bağımsız olarak gelişmiştir. Halofit adı verilen bu bitkiler, özellikle kıyı bölgelerinde veya toprağın yüksek konsantrasyonda sodyuma sahip olduğu diğer alanlarda yaygındır. Şeker pancarı, lahana ve birçok C4 otu gibi halofitler tuza dayanıklıdır, çünkü sodyumu merkezi silindirden yaprak hücrelerinin vakuollerine taşıyabilirler, burada ozmotik olarak etkili bir iyon olarak turgoru arttırır ve böylece artar. hücre uzaması ve potasyum yerine yaprak alanı büyümesini olumlu yönde etkiler. Sodyum bu nedenle kısmen potasyumun yerini alır, ancak başka bir kısımda ayrıca büyümeyi teşvik edici bir etkisi vardır.
Sodyumu merkezi silindirden yaprak hücrelerine taşıyamayan bitkiler, sodyumu ksilem parankiminde biriktirir. Bu sözde natrofob bitkiler, diğerlerinin yanı sıra fasulye ve mısırı içerir. Sodyum, yaprak hücrelerine girerse vakuollere taşınamaz, hücre plazmasında (sitosol) kalır ve polimer oluşumu için önemli olan potasyumun yerini alır (sodyum kaynaklı potasyum eksikliği) . Bu sonuçta fotosentezin inhibisyonuna yol açtı. Sodyum konsantrasyonu yüksek olduğunda, kökün merkez silindirinde ve gövde dokusunda sodyum birikmesi bitki üzerinde olumsuz bir etkiye sahiptir. Ozmotik değerin artması suyu emmesini ve taşımasını engeller. Yapraklar, su ve besinlerle yetersiz beslenir, bu da fotosentezde bir azalmaya yol açar.
Çoğu bitki yalnızca az miktarda sodyum içerdiğinden, birçok otobur, doğal tuz birikintilerinden ilave sodyum klorür almak zorundadır.
emniyet
Daha az miktarda sodyum petrol altında depolanır. Daha büyük miktarlar için koruyucu gaz atmosferine sahip entegre taşıma sistemleri vardır. Koruyucu gaz veya petrole rağmen, sodyum genellikle bir sodyum hidroksit ve sodyum oksit tabakası ile kaplanır.
Sodyum yangınları metal yangın tozu (sofra tuzu), potasyum klorür, gri dökme demir talaşı veya kum veya kuru çimento ile geçici olarak söndürülebilir. Ancak kum ve çimento, sodyum ile bir dereceye kadar reaksiyona girer ve bu da söndürme etkisini azaltır. Hiçbir koşulda su, köpük, kuru toz, karbon dioksit veya halonlar kullanılmamalıdır. Bu söndürme maddelerinden bazıları, daha şiddetli yangınlara ve patlamalara yol açabilecek şekilde, sodyum ile güçlü bir şekilde ekzotermik olarak reaksiyona girer.
Bağlantıları
Bileşiklerde sodyum, yalnızca +1 oksidasyon durumunda meydana gelir. Tüm bileşikler güçlü bir iyonik karaktere sahiptir ve hemen hemen hepsi suda kolayca çözünür. Sodyum bileşikleri birçok asidin en önemli tuzları arasındadır. Sodyum tuzları, sentezleri ucuz olduğu için çoğunlukla endüstriyel olarak karşılık gelen anyonları elde etmek için kullanılır.
halojen bileşikleri
Genellikle sofra tuzu veya sofra tuzu olarak adlandırılan sodyum klorür (NaCl), en önemli ve en iyi bilinen sodyum tuzudur. Büyük miktarlarda oluştuğu için sodyum ve diğer sodyum bileşiklerinin ekstraksiyonu için en önemli hammaddedir. Sodyum klorür insanlar için en önemli sodyum kaynağıdır.Teknik olarak, diğer şeylerin yanı sıra yiyecekleri korumak ve karayolu trafiğinde yol tuzu olarak kullanılır. Adını, birçok tuzun tipik bir kristal yapısı olan sodyum klorür yapısından alır.
Ek olarak, diğer tüm olası sodyum halojenürler, yani sodyum florür NaF, sodyum bromür NaBr ve sodyum iyodür NaI bilinmektedir ve kararlıdır.
oksijen bileşikleri
Toplam beş sodyum oksit bilinmektedir. Bunlar sodyum oksit Na2O, sodyum peroksit Na2O2, sodyum hiperoksit NaO2, disodyum trioksit Na2O3 ve sodyum trioksit NaO3'tür. Sodyum oksit birçok camda bulunur; cam üretiminde kullanılan sodyum karbonattan oluşturulur. Sodyum yandığında sadece belirli sıcaklıklarda (150–200°C) üretilir ve stokiyometrik olarak kullanılan miktarlarda sodyum ve oksijen kullanılır. Durum böyle değilse, sodyum yanarak sodyum peroksite dönüşür. Bu güçlü bir oksitleyici ajandır ve teknik olarak en önemli sodyum oksittir. Tekstil ve kağıt için ağartıcı olarak ve ayrıca dalış ve denizaltılarda oksijen kaynağı olarak kullanılır. Diğer oksitler çok kararsızdır ve hızla ayrışır.
Sodyum hidroksit (NaOH), endüstrideki en önemli bazlardan biridir. Sulu sodyum hidroksit çözeltisine kostik soda denir. Diğer şeylerin yanı sıra, sabun ve boya üretimi ile alüminyum üretiminde boksitin parçalanması için kullanılır.
kükürt bileşikleri
Sodyum, hidrojen sülfür, sodyum sülfür Na2S ve sodyum hidrojen sülfür NaHS ile iki tuz oluşturur. Her ikisi de diğer şeylerin yanı sıra ağır metal çökeltme için kullanılır.
Sülfürik asidin sodyum tuzu olan sodyum sülfat Na2SO4, deterjanlarda ve kağıt endüstrisinde sülfat prosesinde kullanılmaktadır. Diğer iki değerli anyonlar gibi sülfat da sodyum sülfata ek olarak sodyum hidrojen sülfat oluşturur. Diğer oksi-kükürt asitleri de sodyum tuzları oluşturur. Bir örnek, analog fotoğrafçılıkta sabitleme tuzu olarak kullanılan sodyum tiyosülfat Na2S2O3'tür.
hidrürler
Sodyum hidrit NaH ve sodyum borohidrit NaBH4'te hidrojen, -1 oksidasyon durumundadır. Her ikisi de öncelikle organik kimyada kullanılır. Sodyum hidrit esasen tiyollerin, alkollerin, amidlerin, CH-asidik bileşiklerin, vs. deprotonasyonu için güçlü, küçük bir nükleofilik baz olarak kullanılırken, sodyum borohidrit z'yi azaltmak için kullanılır. B. ketonlar. İkinci reaksiyon, seryum (III) bileşiklerinin (Luche indirgemesi) mevcudiyeti ile ketonlar için seçici olarak gerçekleştirilebilir. Su ile temas ederse, gaz halinde hidrojen H2 üretilir.
Daha fazla sodyum bileşikleri
Sodyum karbonat Na2CO3 ve sodyum hidrojen karbonat NaHCO3, karbonik asidin sodyum tuzlarıdır. Sodyum klorür ve sodyum hidroksit ile birlikte en önemli sodyum bileşikleri arasındadırlar. Sodyum karbonat (genellikle soda adıyla anılır) cam üretiminde büyük miktarlarda kullanılır. Sodyum hidrojen karbonat kabartma tozu olarak kullanılır. Isıtıldığında asitlerle karbondioksit ve su oluşturur.
Nitrik asidin sodyum tuzu olan sodyum nitrat NaNO3, doğal olarak oluşan nadir nitrat bileşiklerinden biridir (Şili nitratı). Sodyum nitrat gübre ve koruyucu olarak kullanılır.
Organik sodyum bileşikleri, lityumun aksine çok kararsızdır. Son derece reaktiftirler ve bazen reaktif olmayan alifatik hidrokarbonlarla reaksiyona girebilirler. Sadece, indirgeyici ajanlar olarak kullanılabilen siklopentadien gibi aromatik radikallere sahip bileşikler, reaksiyonlardaki uygulamalar için yeterince kararlıdır.
Sabunlar, yağ asitlerinin sodyum veya potasyum tuzlarıdır. Üretim için yağlar kostik soda veya potasyum hidroksit çözeltisi ile kaynatılır. Bu işleme sabun kaynatma, kimyasal reaksiyon sabunlaştırma denir. Yağlar, gliserin ve yağ asitlerinin alkali tuzlarına (gerçek sabunlar) ayrılır. Alternatif olarak, sabunlar, tuzlarını oluşturmak üzere alkalilerle reaksiyona sokularak doğrudan serbest yağ asitlerinden yapılabilir. Uygun yağ asitleri örneğin laurik asit, miristik asit, palmitik asit, stearik asit, oleik asit ve risinoleik asittir.






