İndiyum, İçinde, atom numarası 49
İndiyum fiyatı, oluşumu, çıkarılması ve kullanılması
Allgemein
İndiyum, In sembolü ve atom numarası 49 olan kimyasal bir elementtir. Elementlerin periyodik tablosunda 5. periyotta olup 3. ana grubun (yeni sayıma göre grup 13) veya bor grubunun dördüncü elementidir. İndiyum nadir, gümüşi beyaz ve yumuşak bir ağır metaldir. Yerkabuğundaki bolluğu gümüşinkiyle karşılaştırılabilir. İndiyum insan vücudu için gerekli değildir ve herhangi bir toksik etkisi bilinmemektedir. Metalin çoğu artık düz ekranlar ve dokunmatik ekranlar için şeffaf bir iletken olarak kullanılan indiyum kalay oksit olarak işleniyor. Milenyumun başlangıcından bu yana, buna bağlı artan talep, indiyum fiyatlarında önemli bir artışa ve mevduatın çeşitliliği hakkında tartışmalara yol açtı.
Indium, 1863 yılında Bergakademie Freiberg'de Alman kimyager Ferdinand Reich ve Theodor Richter tarafından keşfedildi. Talyum için bölgede bulunan bir sfalerit örneğini incelediler. Beklenen talyum çizgileri yerine, absorpsiyon spektrumunda daha önce bilinmeyen bir indigo mavisi spektral çizgisi ve dolayısıyla daha önce bilinmeyen bir element buldular. Yeni element daha sonra bundan sonra adlandırıldı. Kısa bir süre sonra başlangıçta indiyum klorür ve oksit ve indiyum oksidi hidrojenle indirgeyerek metal üretebildiler. Büyük miktarda indiyum ilk olarak 1867'de Paris'teki Dünya Sergisinde gösterildi.
1933 yılında diş altınında alaşım bileşeni olarak ilk kullanımından sonra, indiyumun yaygın kullanımı İkinci Dünya Savaşı ile başladı. Amerika Birleşik Devletleri bunu yüksek gerilimli uçak rulmanlarında kaplama olarak kullandı. İkinci Dünya Savaşı'ndan sonra indiyum ağırlıklı olarak elektronik endüstrisinde lehim malzemesi olarak ve düşük erime noktalı alaşımlarda kullanıldı. Nükleer enerji kullanımının artmasıyla birlikte nükleer reaktörlerin kontrol çubuklarında kullanımı da önem kazanmıştır. Bu, 1980 yılına kadar indiyum fiyatında ilk keskin artışa yol açtı. Ancak Three Mile Island reaktör kazasından sonra hem talep hem de fiyat önemli ölçüde düştü.
1987'den itibaren iki yeni indiyum bileşiği, yarı iletken indiyum fosfit ve ince tabakalarda iletken ve şeffaf olan şeffaf indiyum kalay oksit geliştirildi. Özellikle indiyum kalay oksit, sıvı kristal ekranların geliştirilmesiyle teknik olarak ilgi çekici hale geldi. Yüksek talep nedeniyle, indiyumun çoğu 1992'den beri indiyum kalay okside işlendi.
Bulunduğu
İndiyum nadir bir elementtir, kıta kabuğundaki payı sadece 0,05 ppm'dir. Bu nedenle gümüş ve cıva ile benzer bir frekanstadır. Katı haldeyken, indiyum sadece Doğu Sibirya'da tek bir bulgunun içinde bulundu. Sadece birkaç indiyum minerali bilinmektedir. Bunlar esas olarak Indit FeIn gibi sülfidik minerallerdir.2S4 ve Roquésit CuInS2. Ancak bunlar nadirdir ve indiyumun çıkarılmasında rol oynamaz. En büyük indiyum yatakları çinko cevherlerindedir, özellikle sfalerittir. Teorik rezervlerin 16.000 ton olduğu tahmin edilmektedir ve bunun yaklaşık 11.000 tonu ekonomik olarak geri kazanılabilir. En büyük mevduatlar Kanada, Çin ve Peru'da. Indiyum içeren cevherler ayrıca Avustralya, Bolivya, Brezilya, Japonya, Rusya, Güney Afrika, ABD, Afganistan ve bazı Avrupa ülkelerinde de bulunmaktadır. Almanya'da Ore Dağları'nda (Freiberg, Marienberg, Geyer) ve Harz Dağları'ndaki Rammelsberg'de yataklar bulunmaktadır.
Çıkarma ve sunum
İndiyum, neredeyse sadece çinko veya kurşun üretiminde bir yan ürün olarak elde edilir. Üretim sürecinin belirli noktalarında indiyum birikmesi halinde ekonomik ekstraksiyon mümkündür. Bunlar, çinko sülfitin kavrulması sırasında oluşan baca tozlarını ve çinko üretiminin ıslak işlemi sırasında elektroliz sırasında geride kalan kalıntıları içerir. Bunlar sülfürik asit veya hidroklorik asit ile reaksiyona girerek çözelti haline getirilir. Asitte indiyum konsantrasyonu çok düşük olduğu için zenginleştirilmesi gerekir. Bu, örneğin tribütil fosfat ile ekstraksiyon veya indiyum fosfat olarak çökeltme yoluyla yapılır.
Gerçek indiyum üretimi elektrolitik olarak gerçekleşir. Bunun için hidroklorik asit içinde bir indiyum (III) klorür çözeltisi kullanılır. Bu, cıva elektrotları yardımıyla elemental indiyum'a dönüştürülür. Elektroliz sırasında, iki elementin standart potansiyelleri çok benzer olduğu için solüsyonun artık talyum içermemesine dikkat edilmelidir.

Ham ürün, bölge eritme prosesleri veya indiyum (I) klorür tuzu eriyiklerinin tekrarlanan elektrolizi gibi uygun proseslerle daha da saflaştırılabilir ve böylece% 99,99'un üzerinde saf indiyum elde edilebilir.
Üretim
İndiyumun birincil üretimi (maden üretimi), 2006 yılında 500 arasındaydı. ve 580 ton. 11.000 tonluk düşük doğal rezervler ve yüksek talep nedeniyle, indiyum dünyadaki en nadir hammaddelerden biridir. 2008 yılında, özellikle Çin için, doğal indiyum rezervlerine ilişkin bilgiler 280'den 8.000 tona çıktı ve bu da statik aralığı 6'dan 19 yıla çıkardı. İkincil üretim, yani geri dönüşüm, birincil üretimi aştı ve 2008'de 800 ton oldu.
Çin'deki indiyum üretimi ancak son zamanlarda arttı. 1994 yılında üretilen miktar 10 tondu. O zamandan beri, Çin'in dünya üretimindeki payı 60 yılında% 2005'a yükseldi. Japonya, Kanada veya Fransa gibi diğer ülkelerde üretim, mevduatın tükenmesi nedeniyle ancak küçük bir ölçüde artırılabildi veya azaltılabildi. Örneğin 2006 yılında Japon Toyoha madeni kapatıldı ve bu nedenle buradaki üretim önemli ölçüde azaldı.
Indiyum talebi üretimden daha hızlı arttığından, indiyum fiyatı 97'de 2002 $ 'dan 827 yılında 2005 $' a yükseldi. İndiyum, esas olarak püskürtmeden elde edilen kalıntıların geri dönüştürülmesiyle geri dönüştürülüyor. Şu anda indiyumun büyük miktarlarda geri kazanıldığı tek ülke Japonya'dır.
Talep artmaya devam ederse ve fiyat artarsa, yalnızca az miktarda indiyum içeren malzemelerin geri dönüşümü karlı hale gelecektir. Aynı şekilde, düşük indiyum içerikli cevherleri sömürmek de ekonomik bir anlam ifade eder. Bu muhtemelen kaynakların kurumasını geciktirmeyi mümkün kılar.
İndiyum, çoğu uygulamada başka maddelerle değiştirilebilir, ancak bu genellikle ürünün özelliklerini veya üretimin karlılığını kötüleştirir. Örneğin, indiyum fosfit galyum arsenit ile değiştirilebilir ve daha düşük kalitede olsa da indiyum kalay oksit için bazı ikameler mümkündür.
özellikleri
Fiziksel özellikleri
| kristal sistemi | dörtgen şeklinde |
| alan grubu |  |
| kafes parametreleri
(Birim hücre) |
a = (b) = 325
c = 495 pm |
| Sayısı (Z)
formül birimleri |
Z = 2 |

Merkezi indiyum atomunun koordinasyon ortamıyla birlikte indiyum birim hücresi

Bozulmuş küpoktahedron şeklinde 4 + 8 = 12 komşu atomdan oluşan bir indiyum atomunun koordinasyon polihedronu
İndiyum, düşük erime noktası 156,5985 ° C olan gümüşi beyaz bir metaldir. Metaller arasında sadece cıva, galyum ve çoğu alkali metal daha düşük bir erime noktasına sahiptir. Metal, neredeyse 2000 K gibi çok geniş bir aralıkta sıvıdır. Sıvı indiyum cam üzerinde kalıcı olarak ince bir film bırakır (ıslanma). Benzer galyum aynı özelliğe sahiptir.
Metal, yüksek sünekliğe ve çok düşük sertliğe sahiptir (Mohs sertliği: 1,2). Bu nedenle indiyum gibi sodyum gibi bir bıçakla kesmek mümkündür. Aynı zamanda kağıt üzerinde gözle görülür bir çizgi bırakır. İndiyum, 3,41 Kelvin geçiş sıcaklığının altında süper iletkendir. Kalay ile ortak olan bir indiyum özelliği, indiyum büküldüğünde duyulabilen karakteristik seslerdir (“kalay çığlıkları”).
Normal koşullar altında indiyumun sadece bir kristalin modifikasyonu bilinmektedir, bu, uzay grubundaki tetragonal kristal sistemindedir.  ve böylelikle ızgara parametreleri ile dörtgen gövde merkezli bir ızgarada a = 325 pm ve c = 495 pm ve iki formül birimi birim hücrede kristalleşir.
ve böylelikle ızgara parametreleri ile dörtgen gövde merkezli bir ızgarada a = 325 pm ve c = 495 pm ve iki formül birimi birim hücrede kristalleşir.
Bir indiyum atomu, kristal yapıda, dördü komşu birim hücrelerden gelen ve birim hücrenin köşelerindeki sekiz atomdan (325 pm; yeşil bağlar) daha yakın olan (337 pm; kırmızı bağlar) on iki diğer atomla çevrilidir. Koordinasyon numarası 4 + 8 = 12, koordinasyon polihedronu olarak bozuk bir küpoktahedron ile sonuçlanır. Kristal yapı bu nedenle dörtgen olarak bozulmuş, en yakın kübik küreler olarak tanımlanabilir.
Yüksek basınç deneylerinde 45 GPa'nın üzerinde stabil olan ve uzay grubundaki ortorombik kristal sistemde başka bir değişiklik keşfedildi. Fmmm kristalize.
Kimyasal özellikleri
Indiyumun kimyasal özellikleri, grup komşuları galyum ve talyumunkilere benzer. Diğer iki element gibi indiyum da pek çok metal olmayan ile yüksek sıcaklıklarda reaksiyona girebilen temel bir elementtir. Havada oda sıcaklığında stabildir çünkü alüminyum gibi yoğun bir oksit tabakası oluşur ve bu da malzemeyi pasifleştirme yoluyla daha fazla oksitlenmeye karşı korur. Indiyum (III) okside reaksiyon yalnızca yüksek sıcaklıklarda gerçekleşir.
İndiyum, nitrik asit veya sülfürik asit gibi mineral asitler tarafından saldırıya uğramasına rağmen, sıcak suda, alkalilerde ve çoğu organik asitlerde çözünür değildir. Tuzlu su bile indiyumlara saldırmaz. İndiyum, cıva içinde oda sıcaklığında en çözünür metaldir.
izotop
38 farklı izotop ve 45 başka indiyum izomeri vardır. 97İçine 135Biliniyor. Doğada sadece iki izotop oluşur, 113(64 nötron) içinde% 4,29 ve 115Doğal izotop dağılımında% 66 pay ile (95,71 nötron). Ortak izotop 115Zayıf radyoaktif, yarı ömrü 4,41 · 10 olan bir beta yayıcıdır.14 Yıl. Her iki doğal izotop da NMR spektroskopisi yardımıyla tespit edilebilir. En kararlı yapay izotoplar 111Ve içinde 114mBirkaç günlük yarı ömürlerde, 113mSadece bir buçuk saat içinde. 111Ve içinde 113mNükleer tıpta kullanılmaktadır.
Kullanım
Maden

İndiyum contalarda indiyum tel kullanılır.
Indium çok yönlüdür, ancak kullanımı nadir ve yüksek fiyatı ile sınırlıdır. Üretilen indiyumun çoğu metal olarak kullanılmaz, ancak bir dizi bileşik halinde işlenir. Yalnızca indiyum kalay oksit üretimi için 2000 yılında toplam indiyum üretiminin% 65'i kullanılmıştır. İndiyum fosfit ve indiyum arsenit gibi diğer bileşikler de üretilen indiyumdan elde edilir. İndiyum bileşiklerinin kullanımına ilişkin daha fazla ayrıntı, bu bölümde bulunabilir. Bağlantıları.
Metalik iş parçaları, galvanik olarak biriktirilmiş indiyum kaplamalarla korunabilir. Örneğin bu şekilde kaplanmış çelik, kurşun veya kadmiyumdan yapılmış malzemeler organik asitlerden veya tuz solüsyonlarından kaynaklanan korozyona ve hepsinden önemlisi aşınmaya karşı daha dirençlidir. Geçmişte, indiyum koruyucu tabakalar genellikle otomobillerde veya uçaklarda kaymalı yataklar için kullanılıyordu. Bununla birlikte, indiyum fiyatındaki keskin artıştan bu yana, bu artık ekonomik değildir. İndiyum ile kaplanmış yüzeyler, tüm renklerde yüksek ve tekdüze bir yansıma derecesine sahiptir ve bu nedenle ayna olarak kullanılabilir.
Indiyumun erime noktası nispeten düşüktür ve çok hassas bir şekilde belirlenebilir. Bu nedenle sıcaklık skalasını kurarken sabit noktalardan biridir. Bu özellik, Dinamik Diferansiyel Kalorimetride (DSC) kalibrasyon için de kullanılır.
Hem yavaş hem de hızlı nötronlar için büyük yakalama kesiti nedeniyle indiyum, nükleer reaktörlerdeki kontrol çubukları için uygun bir malzemedir. İndiyum folyolar, nötron detektörleri olarak da kullanılabilir. İndiyum gaz geçirmezdir ve düşük sıcaklıklarda bile deforme olması kolaydır ve bu nedenle kriyostatlarda indiyum contalarda kullanılır.
İndiyum ayrıca bazı özel özelliklerinden dolayı birçok malzeme için lehim görevi görür. Sadece soğuduğunda hafifçe deforme olur. Bu, transistörler için yarı iletkenleri lehimlerken özellikle önemlidir. Indiyumun cam ve seramik gibi metalik olmayan malzemeleri de lehimleyebilmesi de bir rol oynamaktadır.
İlk transistörleri üretmek için "indiyum hapları" ile germanyum plateletleri her iki tarafta alaşımlandı.
alaşımlar
İndiyum birçok metalle alaşım haline getirilebilir. Bu alaşımların çoğu, özellikle bizmut, kalay, kadmiyum ve kurşun metalleri ile 50 ila 100 ° C arasında düşük bir erime noktasına sahiptir. Bu, örneğin sprinkler sistemlerinde, termostatlarda ve sigortalarda olası uygulamalarla sonuçlanır. Kullanılabilen kurşun zehirli olduğu için indiyum zararsız bir ikame görevi görür. Bu alaşımların amacı, yangın veya yüksek akımların neden olduğu çok yüksek ortam sıcaklıklarında erimeleridir. Erime daha sonra devreyi keser veya sprinkler sistemini tetikler. İndiyum-galyum alaşımları genellikle daha da düşük erime noktalarına sahiptir ve yüksek sıcaklık termometrelerinde bulunur. Özel bir galyum-indiyum-kalay alaşımı Galinstan'dır. Bu, oda sıcaklığında sıvıdır ve cıva veya sodyum-potasyum alaşımları için zararsız bir ikame görevi görür.
Farklı alanlarda kullanılan indiyum içeren birkaç başka alaşım vardır. Indiyum, manyetik malzemelerde alaşım bileşeni olarak bakır, manganez ve magnezyum ile birlikte kullanılır. Nadiren gümüş, kalay, bakır, civa ve çinko içeren indiyum (maksimum% 5) amalgam dolgularda katkı olarak kullanılır. Bir CD-RW'nin saklama katmanı, diğer şeylerin yanı sıra indiyum içerir.
kanıt
Olası bir kimyasal kanıt, indiyum iyonlarının asetik asit çözeltisinden 8-hidroksikinolin yardımıyla çökeltilmesidir. Normalde indiyum kimyasal yollarla değil, uygun spektroskopik yöntemlerle tespit edilir. İndiyum, 451,14 nm ve 410,18 nm'de karakteristik spektral çizgiler kullanılarak kolayca tespit edilebilir. Bunlar mavi spektral aralıkta olduklarından, tipik mavi alev rengi ortaya çıkar. X ışını floresan analizi ve kütle spektrometrisi, daha hassas bir niceliksel belirleme için inceleme yöntemleri olarak mevcuttur.
Zehirlilik ve güvenlik
İndiyum metalinin herhangi bir toksik etkisi olduğu bilinmemekle birlikte, sıçanlar ve tavşanlarla yapılan hayvan deneylerinde indiyum iyonlarının embriyonik ve teratojenik etkilere sahip olduğu gösterilmiştir. Tek doz 0,4 mg * kg ile-1 dahil3 Gebe sıçanlarda yarık damak ve oligodaktili gibi deformiteler gözlemlenmiştir. Bu fenomenler, indiyum gebeliğin 10. gününde uygulandığında daha sık bulundu. Aksine, farelerde hiçbir malformasyon gözlenmedi. İndiyum nitratın sucul organizmalar için toksik olduğu bulundu (sucul toksisite).
Kompakt indiyum metal yanıcı değildir. Toz veya toz olarak ince bölünmüş haldeyken diğer yandan birçok metal gibi oldukça yanıcı ve yanıcıdır. Yanan indiyum, üretilen hidrojenden patlama riski nedeniyle su ile söndürülmemeli, metal yangın söndürücüler (D sınıfı) ile söndürülmelidir.
Bağlantıları
İndiyum, bir dizi bileşik oluşturur. Onlarda, metal genellikle oksidasyon durumuna + III sahiptir. Seviye + I daha nadirdir ve daha dengesizdir. Oksidasyon durumu + II mevcut değildir, resmi olarak iki değerlikli indiyumun oluştuğu bileşikler gerçekte tek değerlikli ve üç değerlikli indiyumun karışık bileşikleridir.
indiyum
İndiyum (III) oksit, sarı, kararlı bir tuzdur. Saf indiyum (III) oksit nadiren kullanılır; teknolojide çoğu daha sonra indiyum kalay okside işlenir. Az miktarda kalay (IV) oksit ile katkılanmış indiyum (III) oksittir. Bu, bağlantıyı şeffaf ve iletken bir okside (TCO malzemesi) dönüştürür. Sadece birkaç başka malzemenin sahip olduğu bu özellikler kombinasyonu, geniş uygulama gerektirir. İndiyum kalay oksit, özellikle sıvı kristal ekranlarda (LCD), organik ışık yayan diyotlarda (OLED), dokunmatik ekranlarda ve güneş pillerinde iletken olarak kullanılır. Isıtmalı araba camları ve güneş pilleri gibi diğer uygulamalarda, pahalı indiyum kalay oksit daha ucuz alüminyum katkılı çinko oksit ile değiştirilebilir.
Bileşik yarı iletken
Pek çok indiyum bileşiği, karakteristik bant boşluklarına sahip bileşik yarı iletkenlerdir. Bu, özellikle fosfor, arsenik veya sülfür gibi 15. ve 16. ana grubun elementlerine sahip bileşikler için geçerlidir. 15. ana grubun elemanlarına sahip olanlar III-V bileşik yarı iletkenler, kalkojenli olanlar ise III-VI bileşik yarı iletkenler arasında sayılır. Sayı, iki bağlantı bileşenindeki değerlik elektronlarının sayısına bağlıdır. İndiyum nitrür, indiyum fosfit, indiyum arsenit ve indiyum antimonit, ışık yayan diyotlar (LED), foto diyotlar veya lazer diyotlar gibi farklı diyotlarda farklı uygulamalara sahiptir. Kesin uygulama, gerekli bant aralığına bağlıdır. İndiyum (III) sülfit (In2S3) kadmiyum sülfidin güneş pilleri yerine kullanılan bant aralığı 2 eV olan bir III-VI yarı iletkenidir. Bu bileşiklerin bazıları - en önemlisi indiyum fosfit ve indiyum arsenit - nanoteknolojide rol oynar. İndiyum fosfit nanotelleri güçlü bir anizotropik fotolüminesansa sahiptir ve muhtemelen oldukça hassas fotodetektörlerde veya optik anahtarlarda kullanılabilir.
Basit bileşik yarı iletkenlere ek olarak, birden fazla metal içeren yarı iletken bileşikler de vardır. Bir örnek indiyum galyum arsenittir (xGa1-XAs) galyum arsenide kıyasla azaltılmış bant aralığına sahip üçlü yarı iletken. Bakır indiyum diselenide (CuInSe2) yüksek derecede ışık absorpsiyonuna sahiptir ve bu nedenle ince film güneş pillerinde (CIGS güneş pilleri) kullanılır.
Diğer indiyum bileşikleri
İndiyum, flor, klor, brom ve iyot halojenleri ile bir dizi bileşik oluşturur. Lewis asitleridir ve uygun vericilerle kompleksler oluştururlar. Önemli bir indiyum halojenür indiyum (III) klorürdür. Bu, diğer şeylerin yanı sıra, organik bileşiklerin indirgenmesi için bir katalizör olarak kullanılır.
Genel formül InR ile organik indiyum bileşikleri de vardır.3 ve InR. Birçok organometalik bileşik gibi, oksijene ve suya duyarlıdırlar. Organik indiyum bileşikleri, yarı iletkenlerin üretiminde doping reaktifleri olarak kullanılır.
| Allgemein | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| İsim, sembol, atom numarası | İndiyum, İçinde, 49 | |||||||||||||||||||||||||||||||||
| dizi | madenler | |||||||||||||||||||||||||||||||||
| Grup, dönem, blok | 13, 5, p | |||||||||||||||||||||||||||||||||
| Görünüş | simli parlak gri | |||||||||||||||||||||||||||||||||
| CAS numarası | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Yer kabuğunun kütle kesri | 0,1 sayfa / dakika'ya kadar | |||||||||||||||||||||||||||||||||
| nükleer | ||||||||||||||||||||||||||||||||||
| atomik kütle | 114,818 u | |||||||||||||||||||||||||||||||||
| Atom yarıçapı (hesaplanmış) | 155 (156) pm | |||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 144 pm | |||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 193 pm | |||||||||||||||||||||||||||||||||
| elektron konfigürasyonu | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. iyonlaşma | 558,3 kJ / mol | |||||||||||||||||||||||||||||||||
| 2. iyonlaşma | 1820,7 kJ / mol | |||||||||||||||||||||||||||||||||
| 3. iyonlaşma | 2704 kJ / mol | |||||||||||||||||||||||||||||||||
| fiziksel olarak | ||||||||||||||||||||||||||||||||||
| Fiziksel durum | fest | |||||||||||||||||||||||||||||||||
| kristal yapı | dörtgen şeklinde | |||||||||||||||||||||||||||||||||
| yoğunluk | 7,31 g / cm3 | |||||||||||||||||||||||||||||||||
| Mohs sertliği | 1,2 | |||||||||||||||||||||||||||||||||
| manyetizma | diyamanyetik ( = -5,1 10-5) = -5,1 10-5) |
|||||||||||||||||||||||||||||||||
| ergime noktası | 429,7485[4] K (156,5985 ° C) | |||||||||||||||||||||||||||||||||
| kaynama noktası | 2345 K (2072 ° C) | |||||||||||||||||||||||||||||||||
| Molar hacmi | 15,76 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||
| buharlaşma ısısı | 231,8 kJ / mol | |||||||||||||||||||||||||||||||||
| kaynaşma ısısı | 3,26 kJ / mol | |||||||||||||||||||||||||||||||||
| buhar basıncı | 1 K'da 1196 Pa | |||||||||||||||||||||||||||||||||
| sesin hızı | 1215 K'de 293,15 m / s | |||||||||||||||||||||||||||||||||
| Özgül ısı kapasitesi | 233 J / (kg · K) | |||||||||||||||||||||||||||||||||
| Elektriksel iletkenlik | 12,5 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||
| ısı iletkenliği | 81,6 W / (m K) | |||||||||||||||||||||||||||||||||
| kimyasal | ||||||||||||||||||||||||||||||||||
| oksidasyon durumları | 3, 1 | |||||||||||||||||||||||||||||||||
| Normal potansiyel | −0,343 V (Giriş3+ + 3e- → In) | |||||||||||||||||||||||||||||||||
| elektronegatiflik | 1,78 (Pauling ölçeği) | |||||||||||||||||||||||||||||||||
| izotop | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| NMR özellikleri | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| emniyet | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
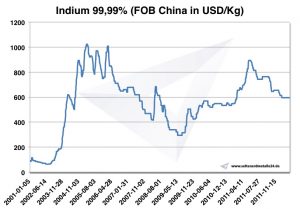
İndiyum fiyatı
Indium Fiyatları -> Stratejik Metal Fiyatları
Grafik Indium 2001-2011



