Krom, Cr, atom numarası 24
Krom - Krom Ekstraksiyon, kullanım, fiyatlar
Genel Bilgileri
Chromium (alt. Chρῶμα chrṓma, color '), Cr sembolü sembolü ve 24 atom numarası içeren kimyasal bir elementtir. Geçiş metallerine aittir, periyodik tablodaki 6'tir. Alt grup (grup 6) veya krom grubu. Krom bileşikleri birçok farklı renge sahiptir ve genellikle boyalarda ve verniklerde pigmentler olarak kullanılır.
kurtarma
Çıkarılan kromit cevheri, ölü kayadan arındırılır. İkinci adımda, kromatı vermek için yaklaşık 1200 ° C'de oksitleyici bir sindirim gerçekleşir:
Sodyum kromat, sıcak suyla ekstrakte edilir ve sülfürik asit ile dikromata dönüştürülür:
Sodyum dikromat, çözeltiden bir dihidrat olarak soğuma üzerinde kristalleşir. Karbonla müteakip bir azalma, krom (III) oksit verir:
Bunu, krom (III) oksidin kroma alüminotermik indirgenmesi izler:
Krom karbür oluşturduğundan, oksidik cevherlerden kömürle indirgenerek krom elde edilemez. Daha saf krom, Cr'nin elektrodepozisyonu ile yapılır.3+Gösterilen sülfürik asit çözeltisinden iyonlar. İlgili çözeltiler, krom (III) oksit veya ferrokromun sülfürik asit içinde çözülmesiyle hazırlanır. Bununla birlikte, başlangıç materyali olarak ferrokrom, demirin önceden ayrılmasını gerektirir.
Son derece saf krom, van-Arkel-de-Boer işlemi kullanılarak daha ileri saflaştırma adımlarıyla üretilir.
Ferrokrom, 2800 ° C'de bir elektrik ark fırınında kromitin indirgenmesiyle üretilir.
özellikleri
Krom, orijinal haliyle sert, dövülebilir ve dövülebilir, gümüş beyazı, korozyona ve kararmaya dirençli sert bir metaldir. 475 K Néel sıcaklığı ile antiferromanyetiktir.[11] Krom, hidroklorik asit ve sülfürik asitte bir süre sonra koruyucu oksit tabakası gittiğinde hidrojen açığa çıkmasıyla çözülür. Yaygın krom oksidasyon seviyeleri +2, +3 ve +6'dır, +3 en kalıcıdır.
Cr (II) d4-Yapılandırma kararsız. Havadaki oksijeni Cr (II) kadar hızlı emen başka bir indirgeme ajanı neredeyse yoktur. Ama hava girişi olmasa bile, Cr2+-Çözümler yalnızca en saf kromdan (örn. Elektrolit krom) elde edilirse kısa bir süre için stabildir.
Cr3+ en kararlı biçimdir. Bu, kristal alan teorisi ile açıklanmaktadır.3 Yapılandırma yarı dolu bir alt kabuk tarafından dengelenir.
Kromat olarak Cr (VI) (CrO42-) veya dikromat (Cr2O72-) güçlü bir oksitleyici ajan olarak kullanılır. Toksik ve kanserojendir. Sulu çözeltilerde, iki iyon arasında pH'a bağlı kimyasal bir denge vardır. Seyreltik sarı bir kromat solüsyonunu asitleştirirseniz, H. verirsiniz.+-LeChatelier'e göre iyonlar ek olarak dikromat yönünde denge kayar, çözelti turuncuya döner.

- Güvenlik talimatları ve biyolojik önemi
Cr'in rolü (III) (Cr3+İyonlar) insan vücudundaki şu anda tartışma konusudur. Cr (III) 'ün memelilerin karbonhidrat ve yağ metabolizmasında rol oynayabileceğine dair göstergeler vardır. Bu bilgiler şu anda takip edilmektedir. Popüler diyet takviyesi Cr (III) -pikolinatın vücut yapısı üzerinde yararlı bir etkiye sahip olduğuna dair önceki göstergeler, sonraki çalışmalarda doğrulanamamıştır. Hamster hücreleri ile yapılan bir araştırma, Cr (III) pikolinatın mutajenik olduğunu ve kansere neden olabileceğini gösterdi.
Şu anda mevcut veriler, bir krom eksikliğinden muzdarip olma ihtimalinin son derece düşük olduğunu göstermektedir. Cr (III) hidroksitin çözünürlük ürünü son derece düşük olduğundan (6,7 x 10-31). Bu nedenle insan bağırsağında emilmesi muhtemelen çok zordur. ABD'de Cr (III) için önerilen alım seviyesi yetişkin erkeklerde 50–200 µg / gün'den 35 µg / gün'e ve yetişkin kadınlarda 25 µg / gün'e düşürülmüştür.
Cr (VI) bileşikleri son derece toksiktir. Mutajeniktirler ve DNA'ya zarar verirler. Vücuda hava yollarından girerler ve akciğer dokusuna zarar verirler. Bu tür bileşiklere kronik olarak maruz kalan kişiler, akciğer kanserine yakalanma riski altındadır. Zehirli etkisi tuzun çözünmezliği ile artar. RoHS direktifi, Avrupa'da Cr (VI) bileşiklerinin kullanımını ciddi şekilde kısıtlamaktadır.
Kullanım
Krom ve krom bileşikleri, dayanıklılığının kullanıldığı çok çeşitli uygulamalarda kullanılır:
- sert krom kaplama: 1 mm kalınlığa kadar bir aşınmaya karşı koruyucu tabakanın doğrudan çelik, dökme demir, bakır üzerine galvanik uygulaması. Alüminyum, bir ara katman uygulandıktan sonra da kromla kaplanabilir (motor yapısında sert krom kaplı alüminyum silindirler).
- Dekorverchromung: Nikel veya nikel-bakırdan yapılmış, korozyona karşı koruyucu bir ara tabaka ile dekorasyon olarak <1 μm kalınlığında bir Cr tabakasının galvanik uygulaması. Plastik parçalar da çok sık krom kaplıdır. Akrolit işlemi, dekoratif krom kaplamanın yerine geçer.
- pasivasyon galvanik çinko tabakaları (kromlama)
- alaşım elementidir: korozyona ve ısıya dayanıklı paslanmaz çeliklerde ve demir dışı alaşımlarda
- Katalizatör: kimyasal reaksiyonları etkinleştirmek veya hızlandırmak
- krom tabaklama: deri yapmanın ana yöntemi
Bağlantıları
- Krom Oksit
- Krom (III) oksit Cr2O3, emaye boya olarak ve camı (yeşil şişeler) renklendirmek için (ayrıca Köln köprüsü yeşili) kullanılır. Bu toksik krom yeşili ile karıştırılmamalıdır.
- sarı krom
- Kurşun (II) kromat PbCrO4, parlak sarı renk pigmenti olarak işlev görmek için kullanılır ("Post sarı"). Toksisitesi nedeniyle artık neredeyse tamamen organik renk pigmentleri ile değiştirilmiştir. Analizde kurşunun iyodometrik tayini için kullanılır.
Bir sanatçının boyası olarak kullanılan krom sarısı, kurşun sülfat / kurşun kromattır (yaklaşık 2 PbSO4 · PbCrO4). Pigment, 1809'da Louis-Nicolas Vauquelin tarafından keşfedildi ve 1820'den beri Almanya'da ticari olarak üretildi. Krom sarısı yüksek örtme gücüne sahiptir, ışık stabilitesi sarı tona bağlıdır. Krom sarısı, yağlı boyamada nadiren kullanılır. Vincent van Gogh, krom sarısı a kullandı. a. tuval üzerine yağlı boya yapılmış meşhur ayçiçeği resimlerinde. Ancak günümüzde bunlardan bazıları sarı tonların renk değiştirmesinden muzdariptir.
Stuttgart Sanat Akademisi'nden pigment kullanımı üzerine sanat teknolojisi uzmanı Prof. Christoph Krekel sarı krom: "Ressamlar krom sarıya düştü, çünkü çok parlak bir sarı - bu çok renkli bir yoğunluğa sahip, yani, bu yeni sarı renk tonu sayesinde daha parlak bir resim yaratabilirsiniz".
Krom sarısı, aynı zamanda "eski" resimlerin sahte analizinde önemli bir renktir.
- krom dioksit
- Krom (IV) oksit CrO2, krom dioksit daha yüksek bir zorlayıcılığa sahip olduğu için, geleneksel demir oksit manyetik bantlardan daha iyi bir sinyal-gürültü oranına sahip manyetik bantların üretimi için siyah ferromanyetik bir tozdur.
- kromik asit
- varsayımsal yapıya sahip H2CrO4 yalnızca seyreltik sulu çözeltide bulunur. Çok zehirlidir. Bazı kromatlarda ve dikromatlarda anyon olarak bulunur.
Kromik asidin anhidriti, çok zehirli krom (VI) oksit CrO3, krom trioksit olarak bilinir.
Turuncu, çok zehirli potasyum dikromat K2Cr2O7 güçlü bir oksitleyici ajandır: Bir sülfürik asit çözeltisinde, birincil alkoller, nefesteki yarı kantitatif alkol tespiti için kullanılabilen ilgili aldehitlere kolayca dönüştürülür. Laboratuvarda şu şekildeydi kromik asit züccaciye temizliğinde kullanılır. Bununla birlikte, klorür iyonlarıyla temas halinde uçucu, kanserojen kromil CrO2Cl2 oluşan (kesinti!). Potasyum dikromat ayrıca endüstriyel boya banyolarında titrant ve fiksatif olarak kullanılır. Potasyum dikromat ve ayrıca çok zehirlidir amonyum dikromat (NH4)2Cr2O7 Erken fotoğrafçılığın krom jelatin katmanlarındaki ışığa duyarlı maddelerdir (bkz. ince baskı süreci).
- kromit
- (Krom demir tuğla, yukarıya bakın) FeCr2O4 tuğla yakmak için kalıp yapımında kullanılır.
Krom fiyatları, grafikler ve geçmiş veriler
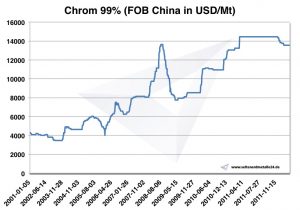
Grafik Kromu 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


