Europium, Eu, sıra 63

Europium, Eu, sıra 63
öropyum hakkında genel bilgi
Europium, Eu sembolü ve 63 atom numarasına sahip kimyasal bir elementtir. Periyodik tablodaki lantanitler grubunda ve bu nedenle nadir toprak metallerine aittir. Europium americium'un yanında, sadece bir kıta öğesinden sonra adlandırılmıştır. Americum, yapay bir tanesidir. metal düşüncelerimizle ilgisi olmayan aktinitlerin radyoaktif transuranı.
Paul Emile Lecoq de Boisbaudran, 1890'u bir samaryum-gadolinyum konsantre bilinmeyen spektral çizgide keşfetti. Elementin keşfi, sadece keşfedilen samaryumda başka bir elementte 1896'ten şüphelenen Eugene Anatole Demarcay'a verilir. 1901, europium'un ayrılmasında onu başardı.
Metalik öropiyum yıllar sonra üretilmedi. Öropiyum yalnızca bileşiklerde bulunur. Birçok mineralde bulunur; Güneşin ve bazı yıldızların tayfında tespit edildi. Monazit ve bastnazit mineralleri teknik olarak önemlidir. Son zamanlarda, bir öropiyum izotopunun bir alfastraler olduğuna dair göstergeler bulunmuştur. Yarı ömür için alt sınır 1,7 trilyon yıl olarak verilmiştir.
Europium'un Tarihi
Daha sonra europium olarak adlandırılan elemente ilk referans, 1885'te William Crookes tarafından bulundu. Samaryum-itriyum karışımlarının floresan spektrumlarını incelerken, elementlerin karışımlarında saf maddelerden daha güçlü olan sıra dışı turuncu renkli bir spektral çizginin sinyallerini ölçebildi. Bilinmeyen bir öğeye işaret eden bu spektral çizgiye "anormal çizgi", varsayımsal öğe Sδ adını verdi. Bilinmeyen elemente giden yolda bir başka keşif, 1892'de Paul Émile Lecoq de Boisbaudran tarafından Samarium'un kıvılcım spektrumunda anormal Crookes çizgisine ek olarak daha önce bilinmeyen üç mavi tayf çizgisini keşfettiği zaman yapıldı. 1896'da Eugène-Anatole Demarçay, samaryum ve gadolinyum arasında ultraviyole spektrumlarına dayalı olarak önceden bilinmeyen bir elementin varlığını öne sürdü ve 1900'de bu elementin Crookes ve Boisbaudran'ınkiyle aynı olması gerektiğini kabul etti. 1901'de Demarçay, samaryum / öropyum magnezyum nitrat çift tuzlarının fraksiyonel kristalizasyonu ile bunu izole etmeyi başardı. Europium elementine Avrupa kıtasının adını verdi. Öropiyuma benzer şekilde, Glenn T. Seaborg, Ralph A. James ve Leon O. Morgan, periyodik tabloda öropyumun hemen altında yer alan aktinoidi, yine bir kıta americium'dan sonra adlandırdılar.
Elemanın ilk önemli teknik uygulaması, europium katkılı itriyum vanadat üretimiydi. 1964 yılında Albert K. Levine ve Frank C. Palilla tarafından keşfedilen bu kırmızı fosfor, kısa sürede renkli televizyonun gelişmesinde önemli bir rol oynadı. Bu uygulama için, 1954'ten beri Mountain Pass, California'da faaliyette olan nadir toprak elementlerinin çıkarılmasına yönelik ilk maden önemli ölçüde genişletildi.
öropyum ekstraksiyonu
Monazit veya bastnaesitten başlayarak, nadir toprakların iyon değişimi, çözücü ekstraksiyonu veya elektrokimyasal biriktirme yoluyla ayrılması gerçekleşir. Son bir işlem aşamasında, yüksek saflıkta europium oksit, metal lantan ile metale indirgenir ve süblime edilir.
Özellikler
Europium en reaktif nadir toprak metallerinden biridir. Havada, parlak gümüşi metal hemen başlar. 150 ° C'nin üzerindeki sıcaklıklarda tutuşur ve kırmızı alevle birlikte sesquioxide Eu2O3'e yanar. Suda, hidrojene hidrojenin evrimi ile reaksiyona girer. 5,244 g / cm3 Europium yoğunluğu ile en hafif ağır metal, bir sonraki daha hafif titanyum (4,507 g / cm3) zaten hafif metallerden biri.
153Eu sabitken, 2007'de 151Eu'nun bir alfa yayıcısı olduğuna dair kanıtlar bulundu. Yarı ömür için alt sınır 1,7 trilyon yıl olarak verilmiştir. Öropiyum ve öropiyum bileşikleri toksik olarak kabul edilmelidir. Metal tozları yanıcı ve patlayıcıdır.
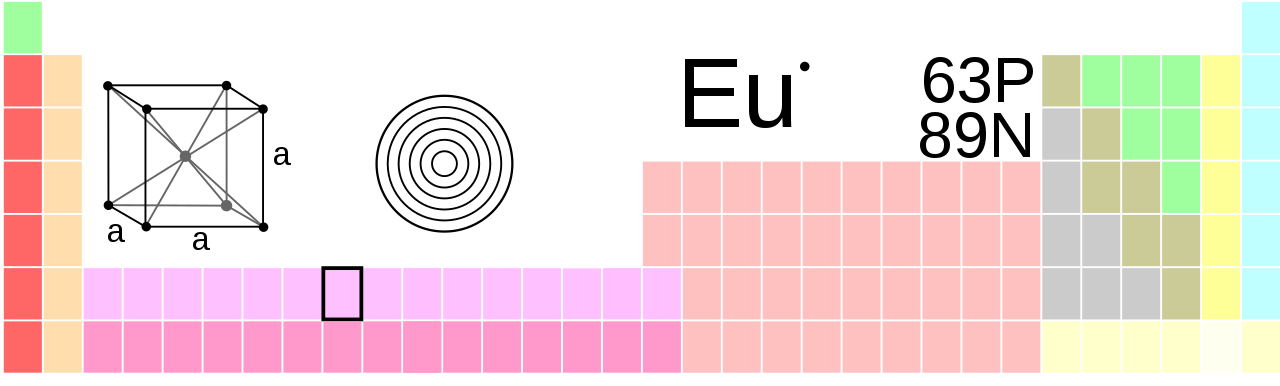
Periyodik tablodaki Europium
öropyum oluşumu
Öropiyum yeryüzünde nadir bulunan bir elementtir, kıtasal kabuktaki bolluğu 2 ppm civarındadır.
Öropiyum, çeşitli lantanit minerallerinde küçük bir bileşen olarak bulunur, ana bileşen olarak öropyumlu mineraller bilinmemektedir. Element, monazit ve bastnesit gibi serit topraklarda ve ayrıca ksenotim gibi ytter topraklarda bulunur, öropyum oranı genellikle %0,1 ile %0,2 arasındadır. Europium çıkarılması için en önemli yatak 1985 yılına kadar California, Mountain Pass'taki bastnäsite cevheriydi, bundan sonra Çin madenleri - özellikle Bayan Obo'daki cevher yatağı - büyük önem kazandı.
Bazı magmatik kayaçlarda, öropyum konsantrasyonu, standart olarak kondritler kullanılarak belirlenen nadir toprak metallerinin nispi bolluk oranından beklenenden daha yüksek veya daha düşüktür. Bu fenomen, öropium anomalisi olarak bilinir ve Eu3+'nın magmada indirgeyici koşullar altında Eu2+'a indirgenebileceği gerçeğine dayanır. Bu, üç değerlikli öropyumdan daha büyük bir iyon yarıçapına sahiptir ve bu nedenle, örneğin potasyum feldispat ve plajiyoklazda stronsiyum veya kalsiyum yerine belirli minerallere kolayca dahil edilir, bu nedenle pozitif bir öropyum anomalisine sahiptir. Bu mineraller magma eriyiğinden kristalleşir ve bu şekilde ayrılırken, üç değerlikli öropyum artık eriyikte çözünmüş halde kalır. Buna karşılık, Eu2 + iyonu, demir, magnezyum ve kalsiyum yerine piroksen ve olivin gibi mafik kayaçlarda kurulum için çok büyüktür ve negatif bir öropyum anomalisi oluşur. Plajiyoklazın kristalleşmesine ek olarak, kayalar eridiğinde bir öropyum anomalisi de ortaya çıkabilir. Kristal ve eriyik arasındaki dağılım katsayısı, diğer nadir toprak elementlerine göre yaklaşık 10 kat daha büyük olduğundan, plajiyoklaz açısından zengin bir kaya kısmen eritildiğinde ve yeniden katılaştığında, eriyik içine sadece küçük bir miktarda öropyum salınır. Negatif bir öropium anomalisi olan kaya. Öropiyum anomalisi, magmatik kayaçların parçalanma derecesinin bir göstergesidir.
Ay kayalarında belirgin bir öropium anomalisi bulundu, ay dağlarının plajiyoklaz açısından zengin kayaları pozitif (artan öropyum içeriği), kraterlerde bulunan bazalt kayaçları ve Maria negatif bir öropium anomalisi gösteriyor. Bu, ayın jeolojik tarihi hakkında sonuçlar çıkarılmasına izin verir. Anortozitleri olan yaylaların yaklaşık 4,6-4,4 milyar yıl önce ay mantosundan farklılaştığı ve bu nedenle bunun öropyumdan yoksun olivin-piroksen kayalarından oluştuğu varsayılmaktadır. Bu mantonun bazaltik kısmi eriyiklerinden oluşan Maria'daki daha genç bazaltlar, bu nedenle, öropyum bakımından çok fakirdir.
Öropiumun çıkarılması ve hazırlanması
Eşlik eden metallere benzerliği ve cevherlerdeki düşük konsantrasyon nedeniyle, diğer lantanitlerden ayrılması zordur, ancak aynı zamanda elementin kullanımı nedeniyle teknik olarak özellikle önemlidir. Monazit veya bastnäsit gibi başlangıç maddelerinin sülfürik asit veya sodyum hidroksit çözeltisi ile sindirilmesinden sonra, çeşitli ayırma yolları mümkündür. İyon değişimine ek olarak, esas olarak sıvı-sıvı ekstraksiyonuna ve Eu3 +'nın Eu2 +'ya indirgenmesine dayanan bir işlem kullanılır. Başlangıç malzemesi olarak bastnäsite durumunda, seryum önce seryum (IV) oksit formunda ayrılır ve kalan nadir toprak elementleri hidroklorik asit içinde çözülür. Daha sonra sıvı-sıvı ekstraksiyonunda DEHPA (di (2-etilheksil) fosforik asit) ve kerosen karışımı yardımı ile öropyum, gadolinyum ve samaryum diğer nadir toprak metallerinden ayrılır. Bu üç element, öropyumu Eu2+'a indirgeyerek ve onu az çözünür öropyum (II) sülfat olarak çökelterek ayrılırken, diğer iyonlar çözelti içinde kalır.
Metalik öropyum, öropyum (III) oksidin lantan veya mischmetal ile reaksiyona sokulmasıyla elde edilebilir. Bu reaksiyon bir vakumda gerçekleştirilirse, öropyum damıtılır ve böylece diğer metallerden ve safsızlıklardan ayrılabilir.
2010 yılında yaklaşık 600 ton öropyum üretildi ve 500 ton tüketildi (her biri öropyum oksit olarak hesaplandı). Ancak, europium'a olan artan talep nedeniyle orta vadede talebin arzı aşmasından ve kıtlık yaşanmasından korkuluyor. Bu nedenle, özellikle Mount Weld, Avustralya'daki gibi ek madenler açarak ve Mountain Pass madenini yeniden açarak, europium üretimini genişletmek için çalışıyoruz. Europium'a olan yüksek talep nedeniyle, elementin fiyatı da keskin bir şekilde arttı. 2002'de hala kilogram başına 240 ABD dolarıydı, 2011'de kilogram başına 1830 dolara yükseldi (her durumda %99 saflık).
Öropiumun fiziksel özellikleri
Diğer lantanitler gibi, europium da gümüşi, yumuşak bir ağır metaldir. Samaryum veya gadolinyum gibi komşu lantanitlerden önemli ölçüde daha düşük ve lantandan daha düşük olan 5,245 g / cm3'lük alışılmadık derecede düşük bir yoğunluğa sahiptir. Aynısı nispeten düşük 826 °C erime noktası ve 1440 °C kaynama noktası (gadolinyum: erime noktası 1312 °C, kaynama noktası 3000 °C) için de geçerlidir. Bu değerler, aksi takdirde geçerli olan lantanid büzülmesine karşıdır ve öropyumun elektron konfigürasyonundan kaynaklanır. Yarı dolu f-kabuğundan dolayı, metalik bağlar için sadece iki değerlik elektronu mevcuttur; bu nedenle, daha düşük bağlama kuvvetleri ve önemli ölçüde daha büyük bir metal atom yarıçapı vardır. Aynı durum iterbiyum için de gözlemlenebilir. Bu eleman ile, tamamen doldurulmuş bir f-kabuğundan dolayı, metalik bağlar için sadece iki değerlik elektronu mevcuttur.
Öropiyum, normal koşullar altında, kafes parametresi a = 455 pm olan, gövde merkezli bir kübik kafes içinde kristalleşir. Bu yapıya ek olarak, iki yüksek basınç modifikasyonu daha bilinmektedir. İtterbiumda olduğu gibi, artan basınçla modifikasyon dizisi diğer lantanoidlerinkine karşılık gelmez. Ne çift altıgen bir yapıda ne de bir samaryum yapısında bir öropyum modifikasyonu bilinmektedir. Metaldeki ilk faz geçişi 12,5 GPa'da gerçekleşir, bu basıncın üzerinde europium, a = 241 pm ve c = 545 pm kafes parametreleriyle altıgen, en yoğun bir yapıda kristalleşir. 18 GPa'nın üzerinde, Eu-III'ün altıgen en yakın küre paketine benzer başka bir yapı olduğu bulundu.
En az 34 GPa'lık yüksek basınçlarda, metaldeki öropyumun elektron konfigürasyonu iki değerlikliden üç değerlikliye değişir. Bu aynı zamanda, yaklaşık 80 GPa'lık bir basınçta ve yaklaşık 1,8K'lık bir sıcaklıkta meydana gelen, elemanın bir süper iletkenliğini de mümkün kılar.
Uygun konakçı kafeslere yerleştirilmiş evropiyum iyonları, belirgin floresan gösterir. Yayılan dalga boyu oksidasyon seviyesine bağlıdır. Eu3 +, yoğun bir kırmızı renge karşılık gelen 613 ve 618 nm arasında konak kafesinden büyük ölçüde bağımsız olarak floresan verir. Öte yandan, Eu2 + emisyonunun maksimumu, konak kafesine daha fazla bağlıdır ve örneğin baryum magnezyum alüminat için mavi spektral aralıkta ve stronsiyum alüminat için yeşil spektral aralıkta (SrAl447O2) 4 nm'dir. : Eu2 +) 520 nm'de.
öropyumun kimyasal özellikleri
Öropiyum tipik bir baz metaldir ve metal olmayanların çoğuyla reaksiyona girer. Lantanitlerin en reaktifidir ve oksijenle hızlı reaksiyona girer. Yaklaşık 180 °C'ye ısıtılırsa, havada kendiliğinden tutuşur ve öropyum (III) oksit oluşturmak üzere yanar.
Europium ayrıca trihalojenürler oluşturmak için halojenler flor, klor, brom ve iyot ile reaksiyona girer. Hidrojen ile reaksiyonda, hidrojenin metalin küresel ambalajındaki boşluklara girmesiyle stokiyometrik olmayan hidrit fazları oluşur.
Europium, hidrojen ve renksiz Eu3 + iyonunun oluşumu ile suda yavaş, asitlerde hızla çözünür. Benzer şekilde renksiz Eu2 + iyonu, sulu bir çözeltide katotlarda elektrolitik indirgeme ile elde edilebilir. Sulu çözeltide kararlı olan tek iki değerli lantanit iyonudur. Europium, amonyakta çözünür ve içinde çözünmüş elektronların bulunduğu alkali metallerde olduğu gibi mavi bir çözelti oluşturur.
Sm3 +, Tb3 + ve Dy3 +'ya ek olarak, Eu3 + katyonu, uygun bir komplekste belirli dalga boyları emildiğinde görünür aralıkta ışık yayan lantanit katyonlarına aittir. Üç değerli öropyum katyonu sulu bir çözeltide renksizdir, ancak organik ligandlar geniş bir π-elektron sistemi ile koordine edilirse, anten etkisi, merkezi parçacığın ışıldayan özelliklerinin keskin bir şekilde artmasını sağlar. Ligandın π-elektronları, gelen ışığın (yaklaşık 355 nm) emilen enerjisini Eu5+'nın 3d-elektronlarına iletir, bu sayede bunlar 4f-yörüngesine girer ve ışık geri düştüğünde görünür aralıkta (da yaklaşık 610 nm) yayar.
Europium izotopları
38Eu ile 13Eu arasında toplam 130 izotop ve ayrıca 167 çekirdekli europium izomeri bilinmektedir. Bunlardan biri, 153Eu, istikrarlı, diğeri, 151Eu, uzun süredir istikrarlı olarak kabul ediliyor; Ancak 2007'de, yarı ömrü en az 1,7 trilyon yıl olan bir alfa yayıcı olarak bozunduğuna dair göstergeler bulundu. Bu iki izotop doğada bulunur, 153Eu doğal izotopik bileşimin %52,2'lik payıyla daha yaygın olup, buna göre 151Eu'nun oranı %47,8'dir.
Uranyum ve plütonyumun nükleer fisyonu sırasında 152Eu, 154Eu ve 155Eu gibi birkaç europium izotopu oluşur. 155Eu, toplam fisyon ürünleri miktarının yaklaşık %0,03'lük payı ile fisyon ürünleri arasında en yaygın europium izotopudur. Rongelap Atolü'nde, Castle Bravo nükleer silah testiyle kontaminasyondan üç yıl sonra tespit edilebildi.
öropyum kullanımı
Europium esas olarak, örneğin daha önce bilgisayar ekranları ve televizyonlar için kullanılan katot ışın tüplü ekranlarda, ayrıca uçak aletlerinde ve kompakt floresan lambalarda kullanılan fosfor üretimi için bir katkı maddesi olarak kullanılır. Hem iki değerlikli hem de üç değerlikli öropyumlu fosforlar farklı renkler için kullanılır. Kırmızı fosforlar için öncelikle öropyum (Y2O3: Eu3 +) katkılı itriyum oksit kullanılır; geçmişte itriyum oksisülfid veya ilk önemli kırmızı fosfor olarak itriyum vanadat: Eu3 + da kullanılırdı. Eu2+ çoğunlukla stronsiyum klorofosfat (Sr5 (PO4) 3Cl: Eu2 +, stronsiyum kloroapatit SCAP) ve baryum magnezyum alüminat (BaMgAl11O17: Eu2 +, BAM) gibi bileşiklerde mavi fosfor olarak kullanılır.
Plazma görüntü ekranları, soy gaz plazması tarafından yayılan VUV radyasyonunu görünür ışığa dönüştüren fosforlar gerektirir. Bu amaçla, hem mavi hem de kırmızı spektrum için öropyum katkılı fosforlar kullanılır - mavi ışık için BAM, kırmızı için BO3: Eu3 + (Y, Gd).
Sokak aydınlatmasında kullanılanlar gibi yüksek basınçlı cıvalı lambalarda, ışığın beyaz ve daha doğal görünmesi için cama europium katkılı itriyum vanadat uygulanır.
Nötron emilimi nedeniyle, öropyum nükleer reaktörlerin kontrol çubuklarında kullanılabilir. Öropiyum içeren kontrol çubukları, BOR-60 ve BN-600 gibi çeşitli Sovyet test reaktörlerinde test edildi.
EuropiumHexaBorid olarak, ışıma emisyonu için oksit katotların üretimi için bir kaplama olarak da sunulmaktadır.
Europium floresansı, euro banknotlarının sahteciliğini önlemek için kullanılır.
Bu özellik floresan spektroskopisinde de kullanılabilir. Bu amaçla, öropyum, örneğin belirli bir protein ile tercihen istenen yerde reaksiyona giren ve burada biriken uygun bir kompleks içinde bağlanır.
Öropiumun biyolojik önemi ve toksisitesi
Öropiyum vücutta sadece minimum miktarlarda bulunur ve biyolojik önemi yoktur. Element bitki kökleri tarafından da emilemez.
Çözünür öropyum bileşikleri biraz zehirlidir; öropyum (III) klorür için farelere intraperitoneal uygulama için 50 mg/kg ve oral uygulama için 550 mg/kg'lık bir LD5000 değeri belirlendi. Temel koşullar altında, bağırsakta düşük öropyum alımı ve çözünür öropyum klorürün çözülmeyen öropyum okside hızlı dönüşümü ile ilgili olabilecek hiçbir kronik toksisite belirlenememiştir. Farelerde öropyum (III) hidroksit nanoparçacıkları ile yapılan bir çalışmada belirlendiği gibi, çözünmeyen öropyum bileşikleri büyük ölçüde toksik değildir.
Öropiyum (III) hidroksit nanoparçacıkları ile (ama amorfoz öropyum (III) hidroksitle değil) pro-anjiyogenik bir etki bulundu; bunlar endotel hücrelerinin hücre proliferasyonunu in vitro destekler ve in vivo olarak tavuk yumurtalarında küçük kan damarlarının oluşumunun arttığı gözlemlendi . Bu gözlem için olası bir mekanizma, reaktif oksijen türlerinin oluşumu ve bu nanopartiküller tarafından MAP kinazların aktivasyonudur.
Europium'dan bağlantılar
+2 ve +3 oksidasyon durumlarındaki bileşikler bilinmektedir, bu sayede, tüm lantanitlerde olduğu gibi, üç değerlikli durum daha kararlı olmasına rağmen, iki değerlikli durum da alışılmadık şekilde kararlıdır ve bu nedenle çok sayıda Eu (II) bileşiği mevcuttur. İyonik yarıçaplar oksidasyon durumuna bağlı olarak farklılık gösterir, Eu2 + iyonları Eu3 + iyonlarından daha büyüktür. Altı numaralı koordinasyon ile Eu131 + için 2 pm ve Eu108,7 + için 3 pm'dir. Etkili iyon yarıçapı (referans olarak 140 pm daha büyük ve 14 pm olan bir O2 iyonu kullanan) altı koordinasyon numarası için buna göre 117 pm veya 94,7 pm'dir. Daha yüksek koordinasyon sayılarında iyon yarıçapları daha büyüktür, bu nedenle sekiz numaralı koordinasyondaki Eu2 + için 139 pm'dir.
Öropiyumun oksijen bileşikleri
Evropiyum (III) oksit, Eu2O3, teknik olarak en önemli öropyum bileşiğidir ve diğer öropyum bileşiklerinin üretimi için bir başlangıç malzemesi olarak ve özellikle yoğun kırmızı floresansı olan Y2O3: Eu3 + gibi floresan boyalar için bir katkı maddesi olarak hizmet eder. yaklaşık %10'luk bir öropyum (III) oksit içeriği gösterir. Diğer lantanoid oksitler gibi kübik lantanoid C yapısında kristalleşir.
Öropiyum (II) oksit, EuO, sodyum klorür yapısında kristalleşen 70 K Curie sıcaklığına sahip mor-siyah bir ferromanyetik katıdır. Öropiyum (III) oksidin öropyum ile indirgenmesiyle elde edilebilir ve lantanoidlerin normal koşullar altında kararlı olan tek iki değerli oksitidir. Bu iki okside ek olarak, karışık değerlik oksit öropyum (II, III) oksit Eu3O4 de bilinmektedir.
Diğer öropyum bileşikleri
Eu kalkojenitler (yani sülfürler, selenitler ve tellürler) ve bunların düzensiz alaşımları EuO ile benzer özelliklere sahiptir. Eu1-xSrxS ör. B. x = 0 için bir ferromıknatıs, x≅0.5x için yalıtkan bir döner cam haline gelir ve metalik olmayan davranışı nedeniyle bilgisayar simülasyonları için özellikle uygundur.
Europium, trihalojenürleri oluşturmak için halojenler flor, klor, brom ve iyot ile reaksiyona girer. Bunlar, dihalidlere ve temel halojenlere ısıtıldığında ayrışır.
Evropiyum (III) kromat, aynı mol bir öropyum (III) asetat ve krom (VI) oksit çözeltisinde de oluşturulabilir.
Europium organometalik bileşikler oluşturur. Ancak diğer lantanitlerin aksine, üç değerlikli öropyumun hiçbir siklopentadienil bileşiği sentezlenemez. Üç molekül siklopentadienil ve bir molekül tetrahidrofuran içeren bir bileşik bilinmektedir, ancak bu, öropyuma güçlü bir şekilde bağlıdır ve bileşik önceden ayrıştığı için ısıtma veya vakumla uzaklaştırılamaz. Buna karşılık, öropyum disiklopentadienil (Cp) 2Eu (II) ve diğer bilinen türevler stabildir. İki değerli öropyumun alkinil öropyum bileşikleri de bilinmektedir.
.
Kullanım
- Europium (III) katkılı itriyum oksit sülfit Y2O2S: Eu3 +, renkli resim tüplerinde kırmızı fosforu (lüminofor) oluşturur.
- Europium (II) katkılı baryum fluorobromid BaFBr: Eu2 +, fotosensiyel ışıldama (PSL) için kullanılır
- Eu3 + katkılı katılar genellikle kırmızı bir ışıltı gösterir, Eu2 + tüm optik spektral aralıktaki (UV ila kırmızı) konakçı kafesine bağlı olarak yayılabilir.
- Yüksek basınçlı cıva lambaları ve enerji tasarruflu lambalar gibi ışık kaynakları için fosfordaki doping elemanı.
- Sintilasyon kristallerinde doping materyali (aktivatör olarak).
- NMR spektroskopisinde kaydırma reaktifi olarak organik bileşikler.
- Hidrojen peroksit tespiti için floresans spektroskopisinde Europium-tetrasiklin kompleksleri
- TRFIA = zamanla çözülen floroimmunoassay. Eu3 + iyonları sadece kısa bir süre için suda floresan. Bu nedenle, biri, bir hidrofobik ortam etrafında Eu3 + iyonlarının etrafını oluşturan şelatlama ajanları kullanır. Bu daha uzun bir floresan süresine yol açar. Bu, organik karışımlarda oluşabilecek diğer tüm kısa ömürlü floresanlardan ayırt edilmesini mümkün kılar.
Europium fiyatları
Evropiyum fiyatları -> nadir toprak elementleri fiyatları
Kaynak referans alınarak ücretsiz kullanım için Europium Metall resimleri:

