Zirkonyum, Zr, atom numarası 40
Zirkonyum fiyatı, oluşumu, çıkartılması ve kullanılması
Zirkonyum, sık sık da zirkonyum, Zr element sembolüyle ve sıra numarası 40 olan kimyasal elementtir. Adı en yaygın zirkonyum minerali olan zirkondan türemiştir. Periyodik tabloda 5 içerisindedir. dönemi; 4'in ikinci elemanıdır. Grup (eski 4 alt grubu) veya titan grubu. Zirkonyum korozyona karşı dayanıklı bir ağır metaldir. Biyolojik fonksiyonlar bilinmemektedir; insan organizmasında az miktarda (4 mg / kg) bulunur ve toksik değildir.
Zirkonyum içeren önemli mineral zirkon (Zr [SiO4]) eski çağlardan beri bir değerli taş olarak biliniyor. Bir element olarak zirkonyum, 1789'da Martin Heinrich Klaproth tarafından Seylan'dan gelen bir mineral zirkon numunesinde keşfedildi ve onun adını aldı. Metal, ilk olarak 1824'te Jöns Jakob Berzelius tarafından K.2ZRF6 potasyum ile. Bunu yapmak için ısıttı "Demir tüpte potasyum ile hidroflorik zirkonyum potasyum karışımı". Su ile işlendikten, kurutulduktan ve seyreltik hidroklorik asit ile uzun süre ısıtıldıktan sonra Berzelius, bir "Kömür siyahına benzeyen topaklı toz" ve sadece "Parlatma çeliği ile koyu gri bir renk sıkarak ve parlatarak" Alınan. Öte yandan doğru atom kütlesi 1924 yılına kadar belirlenemedi çünkü - deneylerin uygulanmasındaki hataların yanı sıra - zirkonyumun her zaman küçük miktarlarda hafniyum içerdiği bilinmiyordu. Bu bilgi olmadan, ölçümler her zaman biraz fazla yüksek atomik kütle verdi. Zirkonyumun ilk pratik uygulaması, dumansız flaş tozu.
Bulunduğu
Zirkonyum yer kabuğunda% 0,016 içeriği ile oluşur. Frekans sıralı elemanlar listesinde, zirkonyum 18 üzerindedir. Yer ve klor ve bakırın bilinen unsurlarından daha yaygındır. Çok yaygın olmasına rağmen, genellikle sadece çok küçük miktarlarda ve çok küçük kristallerde bulunur (tipik olarak 0,1 mm civarında). Bu nedenle, antik çağda zirkonyum nadir olarak kabul edilmiştir. Zirkonyum esas olarak granit gibi silikat sızdırma kayalarında bulunur. Onurlu gelmiyor, sadece bazı minerallerde, özellikle de zirkon olarak (ZrSiO)4) ve Baddeleyit (ZrO2) ve daha nadir bulunan kırmızı ödiyalit (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) Önünde bağladı. Neredeyse her zaman hafniyum ile ilişkilidir. Yüksek erime noktası olan 2550 ° C, sertliği ve düşük reaktivitesi nedeniyle, zirkonyum Dünya'da bulunabilen en eski mineraldir ve gömülü uranyum ve toryum izotoplarına dayanan radyometrik yaş tayinleri için kullanılabilir.
Sabun yatakları adı verilen ikincil birikintiler genellikle ham madde olarak kullanılır. Bunlar, çevredeki kaya yıprandığında ve yalnızca özellikle hava koşullarına dayanıklı zirkon kaldığında meydana gelir. Bu tür diğer tortular, zirkonyum kristallerini yıkayan ve başka yerlerde yıkayan su akımlarından kaynaklanabilir. Öte yandan birincil yataklar, genellikle karlı madencilik için çok düşük olan bir zirkonyum içeriğine sahiptir.

Zirkon tanıtımının geçici gelişimi
En önemli zirkonyum yatakları Avustralya, ABD ve Brezilya'dadır. 38 milyon ton geri kazanılabilir rezerviyle, dünyadaki yıllık zirkonyum mineralleri üretimi 2006, 920.000 tonlarındaydı (zirkonyum olarak hesaplandı). Bunlardan sadece% 5 kadarı metal ve alaşımlara işlenir. Başlıca üretici ülkeler, Avustralya ve Güney Afrika'ya kadar 2006 idi.
Çıkarma ve sunum
En yaygın zirkonyum hammaddesi olan Zirkonyum, daha sonraki işlemlerden önce ilk önce zirkonyum dioksite dönüştürülmelidir. Bunun için zirkon bir sodyum hidroksit eriyiğinde kaynatılır (alkali sindirim). Zirkonyum daha sonra zirkonyum karbonitrid (karbon ve azot içeren zirkonyum) oluşturmak için arkdaki kok ile reaksiyona sokulur ve daha sonra zirkonyum tetraklorür oluşturmak için klorin ile reaksiyona sokulur.

Zirkonyum dioksitin karbon ile doğrudan indirgenmesi (yüksek fırın işleminde olduğu gibi) mümkün değildir, çünkü oluşan karbürlerin metalden ayrılması çok zordur. Bunun yerine, zirkonyum tetraklorür, bir helyum atmosferinde magnezyum ile Kroll işleminde zirkonyum metaline indirgenir.

Van Arkel de Boer işlemi, daha saf zirkonyum elde etmek için kullanılır. Vakum altında ısıtma sırasında, zirkonyum başlangıçta iyotla reaksiyona girerek zirkonyum (IV) iyodür oluşturur. Bu, sıcak bir tel üzerinde tekrar zirkonyum ve iyot olarak parçalanır:

Zirkonyum tetraiodide, 200 ° C'de zirkonyum ve iyottan oluşur; 1300 ° C'de tekrar parçalanır
Zirkonyum ve hafniyum basit bir kimyasal şekilde ayrılamaz. Bu nedenle, bu yüksek saflıktaki zirkonyum bile hala hafniyum içermektedir. Zirkonyumun artık hafniyum içermemesi reaktör teknolojisindeki birçok uygulama için önemli olduğundan, bu iki metal için ayırma işlemleri önemli bir rol oynar. Bir olasılık, zirkonyum ve hafniyum bileşiklerinin özel çözücülerde farklı çözünürlüklerinden yararlanıldığı ekstraksiyon yöntemleridir. Sıklıkla, tiyosiyanatlar ve bunların metil izobütil keton içindeki farklı çözünürlükleri kullanılır. Diğer olasılıklar iyon değiştiriciler veya uygun bileşiklerin fraksiyonel distilasyonudur.
özellikleri
Fiziksel özellikleri

Α-zirkonyumun kristal yapısı
Zirkonyum gümüş renkli parlak bir ağır metaldir (yoğunluk 6,501 g / cm3 25 ° C) 'de dıştan çeliğe benzer. Metal, sıcaklık değişikliği ile dönüştürülebileceği iki farklı modifikasyonda kristalleşir. 870 ° C'nin altında, uzay grubundaki altıgen kristal sistemdeki (altıgen yoğun küre paketlemesi, magnezyum tipi) α-zirkonyum kristallenir 6/ mmm grid parametrelerinde a = 323 pm ve c = 514 pm ile birim hücre başına iki formül birimi bulunur. 870 ° C'de, kristal yapı, boşluk grubu ile kübik merkezli β yapısına (tungsten tipi) dönüşür.  ve kafes parametresi a = 361 pm.
ve kafes parametresi a = 361 pm.
Zirkonyum nispeten yumuşak ve esnektir. Haddeleme, dövme ve çekiçleme ile kolayca işlenebilir. Bununla birlikte, metaldeki düşük hidrojen, karbon veya azot kontaminasyon seviyeleri nedeniyle işlenmesi kırılgan hale gelir ve zorlaşır. Elektriksel iletkenlik, diğer metallerinki kadar iyi değildir. Bakırın sadece% 4'idir. Buna karşılık, zirkonyum iyi bir ısı iletkenidir. Erime noktası ve kaynama noktası, daha hafif homolog titanyumla karşılaştırıldığında biraz daha yüksektir (erime noktası: titanyum: 1667 ° C, zirkonyum: 1857 ° C). Ayrıca, elektriksel ve termal iletkenlik daha iyidir. 0,55 K'nin altında, zirkonyum süper iletken olur.
Zirkonyumun ve daha ağır homolog hafniyumun özellikleri, lantanit kasılması nedeniyle çok benzerdir. Bu, benzer atom yarıçaplarını (Zr: 159 pm, Hf: 156 pm) ve dolayısıyla benzer özellikleri gerektirir. İki metal, yoğunlukları bakımından önemli ölçüde farklılık gösterir (Zr: 6,5 g / cm3, Hf: 13,3 g / cm3).
Reaktör yapımında zirkonyumun büyük önem kazandığı için önemli bir özellik, nötronlar için küçük yakalama kesitidir. Bu kapasitede zirkonyum da hafniyumdan çok farklıdır. Bu, bu uygulamalar için karmaşık ayırma sürecini gerekli kılar.
Kimyasal özellikleri
Zirkonyum, özellikle yüksek sıcaklıklarda pek çok metal olmayan ile reaksiyona giren bir baz metaldir. Esas olarak bir toz olarak, azot varlığında ayrıca zirkonyum nitrür ve zirkonyum oksinitrür ile zirkonyum dioksit oluşturmak için beyaz bir alevle yanar. Kompakt metal sadece beyaz ısı olduğunda oksijen ve nitrojen ile reaksiyona girer. Artan basınçta, zirkonyum oda sıcaklığında bile oksijenle reaksiyona girer, çünkü oluşan zirkonyum oksit erimiş metalde çözünür.
Zirkonyum ince, çok yoğun bir zirkonyum oksit tabakası ile havada pasifleştirilir ve bu nedenle inerttir. Bu nedenle hemen hemen tüm asitlerde çözünmez, sadece su regia ve hidroflorik asit oda sıcaklığında zirkonyuma saldırır. Sulu bazlar zirkonyum ile reaksiyona girmez.
izotop
Aralarında zirkonyumun birçok izotopu vardır. 78Zr ve 110Zr bilinen. Doğal zirkonyum, beş izotoptan oluşan karma bir elementtir. Bunlar 90Doğal zirkonyumun% 51,45'lik payı ile en sık meydana gelen Zr ve daha ağır izotoplar 91Zr (% 11,32), 92Zr (% 17,19), 94Zr (% 17,28) ve 96% 2,76 pay ile Zr. 96Zr, zayıf radyoaktif olan tek doğal izotoptur; yarı ömrü 24 · 10'dur.18 Çift beta bozunması altındaki yıllar 96Mo. İzotop 91Zr, NMR spektroskopisi yardımıyla tespit edilebilir.
Kullanım
 Zirkonyum için önemli bir kullanım Zircaloy'un nükleer santrallerdeki uranyum yakıt hücresi kabuklarıdır. Bu alaşım yaklaşık olarak% 90 zirkonyum ve az miktarda kalay, demir, krom veya nikel içerir, ancak hafniyum içermemelidir. Bu elementin seçilmesinin nedeni, aynı zamanda yüksek korozyon direncine sahip termal nötronlar için halihazırda tarif edilmiş düşük yakalama kesitidir; bu, aynı zamanda kimyasal tesisler için, özellikle valfler, pompalar, borular ve ısı eşanjörleri gibi özel aparat parçaları için bir yapı malzemesi olarak uygun olmasını sağlar. Çeliğe alaşım ilavesi olarak korozyon direncini de arttırır. Cerrahi aletler uygun alaşımlardan üretilmiştir.
Zirkonyum için önemli bir kullanım Zircaloy'un nükleer santrallerdeki uranyum yakıt hücresi kabuklarıdır. Bu alaşım yaklaşık olarak% 90 zirkonyum ve az miktarda kalay, demir, krom veya nikel içerir, ancak hafniyum içermemelidir. Bu elementin seçilmesinin nedeni, aynı zamanda yüksek korozyon direncine sahip termal nötronlar için halihazırda tarif edilmiş düşük yakalama kesitidir; bu, aynı zamanda kimyasal tesisler için, özellikle valfler, pompalar, borular ve ısı eşanjörleri gibi özel aparat parçaları için bir yapı malzemesi olarak uygun olmasını sağlar. Çeliğe alaşım ilavesi olarak korozyon direncini de arttırır. Cerrahi aletler uygun alaşımlardan üretilmiştir.
Zirkonyum, az miktarda oksijen ve nitrojen ile reaksiyona girdiğinden, vakumu korumak için akkor lambalarda ve vakum sistemlerinde alıcı malzeme olarak kullanılabilir. Bu özellik ayrıca metalurjide çelikten oksijen, nitrojen ve kükürdü gidermek için kullanılır.
Yandığında çok parlak bir ışık yayabilmesi nedeniyle, flaş toz olarak magnezyumun yanı sıra kullanılmıştır. Magnezyumun aksine, zirkonyum dumansız olma avantajına sahiptir. Bu özellik havai fişek ve sinyal ışıklarında da kullanılır.
Zirkonyum, metal yüzeylere çarptığında bir kıvılcım dalgası yayar ve yanıcıdır. Ordu bunu, özel av tüfeği mühimmatı Dragon's Breath ve ABD-Amerikan çok amaçlı kayma bombası AGM-154 JSOW gibi bazı mühimmat türlerinde kullanıyor. Film teknolojisinde bu efekt, örneğin metal yüzeyler üzerindeki mermilerin piroteknik olmayan etki etkileri için kullanılır.
Zirkonyum-niyobyum alaşımları süper iletkendir ve güçlü manyetik alanlar uygulandığında bile öyle kalır. Bu nedenle süper iletken mıknatıslar için kullanılırlar.
Alüminyum içeren şapların yanı sıra derilerin "beyaz tabaklanmasında" zirkonyum tuzları kullanılır.
emniyet
Zirkonyum ve bileşiklerinin bilinen toksik etkileri yoktur. Yoğun oksit tabakası nedeniyle, kompakt zirkonyum yanıcı değildir. Öte yandan, toz formunda, havada ısıtıldığında yanmaya başlayabilir. Zirkonyum yangınları, suyu söndürmek için kullanılamadığından (hidrojen oluşumu ile şiddetli reaksiyon) ne de karbon dioksit veya halonun kullanılmaması nedeniyle çok tehlikelidir. Zirkonyum yangınları metal yangın söndürücüler (D sınıfı) veya kuru kum ile söndürülmelidir.
kanıt
Alizarin Red-S ile zirkonyum asit, zirkonyum floro kompleksini oluşturmak için florür iyonları eklendiğinde kaybolan karakteristik bir kırmızı-mor bileşik (renkli göl) oluşturur. Bu reaksiyon hem zirkonyum hem de flüorun kalitatif tespiti olarak işlev görebilir. Küçük miktarlarda florür (ve diğer anyonlar) bile etkileşime girdiğinden, bu tespit mineral analizi için uygun değildir. Ek olarak, tanen, Kupferron, fenilarsonik asit, oksin veya ksilenol portakalı gibi bazı başka organik bileşikler, bir belirleme reaktifi olarak uygundur. Diğer bir karakteristik bileşik ise zirkonyum klorür ZrOCl'dir.2 · 8 H2Tipik iğnelerde kristalize olan O. Modern analizde, zirkonyum atomik absorpsiyon spektrometresi (AAS) veya kütle spektrometresi (ayrıca izotop modeli ile) ile tespit edilebilir.
Kantitatif analiz için bir olasılık, az çözünür olan zirkonyum hidroksitin amonyakla çökeltilmesi ve ardından zirkonyaya kalsine edilmesidir.

- Hidroksitin çöktürülmesi
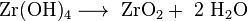
- Tartım kalıbına transfer
Bağlantıları
Bir baz metal olarak zirkonyum çok sayıda bileşik oluşturur. Çoğu zirkonyum bileşiği tuzdur. Genellikle çok kararlıdırlar ve yüksek bir erime noktasına sahiptirler. + IV oksidasyon durumu tercih edilir ve en kararlı olanıdır. Ancak + III ila + I oksidasyon durumlarında ve 0, −I ve −II durumlarında bile komplekslerde bileşikler de vardır.
zirkon
 En önemli zirkonyum bileşiği zirkonyum dioksit ZrO'dur.2, çok kararlı ve refrakter bir oksit. Zirkonyum dioksit potalarda ve fırınlarda refrakter kaplamalar üretmek için kullanılır. Bununla birlikte, onu kullanmak için, kübik yüksek sıcaklık fazını stabilize etmek için kalsiyum, itriya veya magnezya ile dengelenmelidir. Ayrıca, aşındırıcı olarak ve beyaz renk nedeniyle porselen için beyaz bir pigment olarak kullanılır.
En önemli zirkonyum bileşiği zirkonyum dioksit ZrO'dur.2, çok kararlı ve refrakter bir oksit. Zirkonyum dioksit potalarda ve fırınlarda refrakter kaplamalar üretmek için kullanılır. Bununla birlikte, onu kullanmak için, kübik yüksek sıcaklık fazını stabilize etmek için kalsiyum, itriya veya magnezya ile dengelenmelidir. Ayrıca, aşındırıcı olarak ve beyaz renk nedeniyle porselen için beyaz bir pigment olarak kullanılır.
Zirkonyum dioksit kristalleri renksizdir ve yüksek bir kırılma indisine sahiptir. Bu nedenle zirkonya adı altında yapay bir değerli taş ve elmas yerine kullanılmaktadır.
Zirkonyum oksit, itriyum oksit ile karıştırılırsa, başka uygulama olasılıkları ortaya çıkar. Yüzde üç itriyum oksit içeriğinde, ZrO2 çarpık bir florit yapıda stabilize. Sonuç olarak, oksijen iyonları için 300 ° C'nin üzerindeki sıcaklıklarda iletken olarak görev yapar. Bunun için önemli bir uygulama, katalizörün egzoz gazlarındaki oksijen içeriğini ölçmek için kullanılan otomobillerdeki Lambda sondasıdır. 15% yttria içeriğinde, zirkonya, 1000 ° C'de çok parlak, beyaz bir ışık yayar. Bu, sözde Nernst lamba uygulamasında kullanılır. İtriyum-zirkonyum seramikler çok yüksek kırılma tokluğuna sahip olduklarından, örneğin diş hekimliğinde oldukça stabil bir taç ve köprü çerçevesi olarak, yapay kalça eklemlerinde ve diş implantlarında veya teleskoplarda bir bağlantı elemanı olarak kullanılırlar. Bu süreçte, altın ve diğer metallerin işlevlerini giderek daha fazla yerine getiriyorlar.
Zirkonya ayrıca bilyeli rulmanlar için de sıklıkla kullanılmaktadır. Özellikle rulman yarışları için, ZrO2 ısıl genleşme katsayısının çeliğe yakın olması büyük avantajı. Silisyum nitrür gibi diğer teknik seramikler genellikle önemli ölçüde daha düşük bir termal genleşme katsayısına sahiptir.
halidler
Zirkonyum, flor, klor, brom ve iyot halojenleri ile birkaç bileşik serisi oluşturur. Tüm halojenler, ZrX formundaki bileşiklerdir4, ZrX3 ve ZrX2 bilinen. Ayrıca ZrX formundaki klorürler, bromürler ve iyodürler vardır. ZrX formundaki tetrahalidler en kararlı olanlardır4, Zirkonyum halojenürlerin hiçbirinin önemli uygulamalara sahip olduğu bilinmemektedir, zirkonyum klorürler saf zirkonyum hazırlanmasında ara ürünlerdir.
Diğer zirkonyum bileşikleri
Zirkonyum silikat, ZrSiO4Zirkon mineral adıyla daha iyi bilinen, doğada bulunan en yaygın zirkonyum bileşiğidir. Zirkonyum ve bileşiklerinin en önemli kaynağıdır.Zirkon aynı zamanda değerli taş olarak da kullanılmaktadır.
Organik zirkonyum bileşikleri çoğunlukla kararsızdır. Organik zirkonyum kompleksleri, sözde. zirconocenessiklopentadienil gibi radikallerle. Alkenlerin polimerizasyonunda, özellikle de polipropilen üretiminde katalizör olarak teknik olarak önemlidirler. Bir organik zirkonyum bileşiğinin başka bir uygulaması, hydrozirconation, Bu alkenler Schwartz reaktif Cp kullanıyorlar2ZrHCl (Cp = siklopentadienil), alkollere veya halojenli hidrokarbonlara dönüştürülür. Terminal alkinlerin Schwartz reaktifi ile reaksiyonunda hidro-ikame edilmiş trisübstitüe edilmiş çift bağlarda ortaya çıkar, elektrofilik bir reaktif ile daha fazla reaksiyon, yüksek stereokimyasal saflıkta trans-fonksiyonelleştirilmiş alkenlere yol açar.
Alüminyum-zirkonyum kompleksleri terlemeyi önleyici olarak kullanılabilir.
Potasyum heksafloridozirkonat (IV) K2ZRF6 (CAS: 16923-95-8), zirkonyumu hafniyumtan ayırmak için kullanılabilir.
Zirkonyum karbonat, temel bir kompleks olarak mevcuttur. Diğer şeylerin yanı sıra kağıt endüstrisinde kullanılır.
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| İsim, sembol, atom numarası | Zirkonyum, Zr, 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| dizi | Geçiş metalleri | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, dönem, blok | 4, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüş | gümüşi beyaz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS numarası | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Yer kabuğunun kütle kesri | % 0,021 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nükleer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| atomik kütle | 91,224 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı (hesaplanmış) | 155 (206) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 148 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elektron konfigürasyonu | [Kr] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. iyonlaşma | 640,1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. iyonlaşma | 1270 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. iyonlaşma | 2218 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. iyonlaşma | 3313 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fiziksel olarak | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel durum | fest | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifikasyonlar | iki (α- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kristal yapı | altıgen; kübik> 1140 K (867 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| yoğunluk | 6,501 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| manyetizma | paramanyetik ( = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ergime noktası | 2130 K (1857 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kaynama noktası | 4682 K (4409 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar hacmi | 14,02 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| buharlaşma ısısı | 590,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kaynaşma ısısı | 16,9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| buhar basıncı | 0,00168 K'da 2125 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| sesin hızı | 4650 K'de 2250 (uzun), 293,15 (trans.) M / s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Özgül ısı kapasitesi | 270,0 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektriksel iletkenlik | 2,36 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ısı iletkenliği | 22,7 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kimyasal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| oksidasyon durumları | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normal potansiyel | −1,553 V (ZrO2 + 4 H.+ + 4 e- → Zr + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elektronegatiflik | 1,33 (Pauling ölçeği) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR özellikleri | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| emniyet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zirkonyum fiyatları
Zirkonyum fiyatı -> stratejik metal fiyatları


