Tellurium, Te, atom numarası 52
Tellurium fiyatı, oluşumu, çıkarılması ve kullanılması
Tellurium [tʰɛluːɐ̯] (Latince tellus "dünya"), Te sembolü ve 52 atom numarası olan nadir bir kimyasal elementtir. Periyodik tablodaki altıncı ana grupta veya 16'tedir. IUPAC Grubu ve 5. Dönem ve Kalojenlerden biridir. Sıklığı, doğada mineral olarak oluşan çeşitli bileşiklere de girdiği altınınkine benzer. Kristalin tellür, görünüşte kalay ve antimonu andıran gümüş-beyaz, parlak metalik bir yarı metaldir. Mekanik baskıya kırılgan tepki verir ve bu nedenle kolayca ufalanabilir. Metal içermeyen kimyasal bileşiklerde, kükürt ve selenyum davranışlarına yakındır, alaşımlarda ve intermetalik bileşiklerde, ancak çok belirgin (yarı) metalik özellikler gösterir.
Tarih
Tellurium, Sibiu (Alman Hermannstadt) yakınlarındaki Zlatna'daki (Alman Klein Schlatten, Zalatna) Facecebaja Dağı'ndaki Mariahilf madenindeki altın cevherlerinin araştırmasında Avusturyalı kimyager ve mineralog Franz Joseph Mueller von Reichenstein (1782-1740) tarafından 1825'ti. , Transilvanya, Romanya), beklenenden daha az altın verdi. Ignaz von Born'un (1742-1791) Transilvanya'daki benekli Spiesglaskönig'deki bilimsel teziyle cevherlerin farkına varmıştı. Spiesglaskönig katı antimon anlamına gelir, Spies camı mineral Antimonit (Stibnit, Grauss cast Sb2S3) için eski bir isimdir. Von Born, katı metali antimon altın cevherinde tuttu ve düşük verimi altınla antimon kombinasyonuna bağladı. Mueller von Reichenstein bu görüşe aykırı davrandı ve ilk önce “sülfürlü bizmut” için düzenledi. İncelemelerin ardından, sonuçları 1783 ve 1785 arasında dört bölümden oluşan bir makalede yayınladığı, ancak antimon ve bizmuttan farklı olarak, bizzat pratikte sülfürik asit ile reaksiyona girmediği için bizmutu da dışladı. Metalik faza metallum problematicum (ayrıca aurum problematicum veya aurum paradoxum) adını verdi. Mevcut bilgilere göre, Nagyágit (yaprakları, cevher, AuPb (Pb, Sb, Bi) Te2-3S6) ve Sylvanite (font, (Au, Ag) Te2) 'in katı tellürünün yanında bulunur. Mueller von Reichenstein, "belki de henüz yeni tanınmayan bir yarı metal olan" metallum problematicum'un bulgularını istediğini, ancak yalnızca İsveçli mineralog ve kimyager Torben Olof Bergman (1735-1784) tarafından onaylandığını söyledi. 1783 yılında incelemesi için cevher örneklerini Bergman'a gönderdi, ancak kesin cevap alamadı. Bergman, 1784’ten öldü ve şu an için metallum problematicum hakkındaki araştırmalar durduruldu.
On iki yıl sonra, 1797 yılında, Martin Heinrich Klaproth (1743-1817), Berlin'deki Müller von Reichenstein'dan cevher örnekleri aldı. Klaproth, Müller von Reichenstein'ın soruşturmasının sonuçlarını doğruladı ve yeni bir unsurun keşfi için yeterli kanıtı gördü. Ocak ayında 1798 Klaproth, bir derste Müller von Reichenstein'ın esasına övgüde bulundu ve kendisine yeni unsurun keşfini verdi. Mueller von Reichenstein elemente isim vermemiş olduğundan, Klaproth Tellurium (Latin tellus: "earth") ismine karar verdi:
Kimyasal mineralojideki bu boşluğu doldurmak için, burada asıl sonucu eski Ana Dünya'dan ödünç verilen Tellurium adını eklediğim yeni bir tuhaf metalin keşfedilmesi ve doğrulanması olan bu kıymetli cevherlerle ilgili deneyimlerimi ve deneyimlerimi sunuyorum. "
Klaproth'un sahip olduğu Zlatna tipi mekan örnek örneğinin orijinal el kısımları bugün Berlin'deki Doğa Tarihi Müzesi'nde.
Müller von Reichenstein ve Klaproth’tan bağımsız olarak, 1789 Macar kimyager ve botanikçi Paul Kitaibel’i (1757-1817) Macaristan’daki maden ocağı Nagybörzsöny’den (Deutsch-Pilsen) aldıkları altın cevheri araştırmalarında anlatıyor. Klaproth, yayınlanan dersinde, yalnızca Müller von Reichenstein’dan bahsetti, ancak 1796’ten bir kitabında yer alan Kitaibels’in de yaptığı incelemelerin farkındaydı. Kitaibel'e yazdığı bir mektupta Klaproth, el yazmasının içeriğini kaybettiğini ve cevher Müller von Reichenstein'ın araştırmalarında yaptığı çalışmalarla hiçbir bağlantı görmediğini açıkladı. Sonunda Klaproth, Kitaibel’i birkaç yıl önce yeni öğeyle ilgili aynı gözlemleri yaptığı gibi, tellürün keşfedilmesinin yalnızca Mueller von Reichenstein’a atfedilmesi gerektiğine ikna etti.
"Te" element sembolü, Jöns Jakob Berzelius (1814-1779) tarafından 1848'e önerildi ve bugün hala kullanılıyor. Kristalin tellürün X-ışını difraksiyonu ile ilk yapı aydınlatması 1924 idi.
Bulunduğu
Tellurium nadir bir elementtir; yer kabuğuna olan katkısı, 0,01 ppm (g / t) civarındadır. Altın, gümüş, bakır, kurşun ve bizmutun yanısıra platin metallerin yanında, nadiren onurlu, yani doğada elemental formda oluşur.
Katı tellür, element grubuna, daha kesin olarak yarı metal ve metal olmayan bir gruba aittir ve Strunz'e göre I / B.03-40 (8 baskısı) veya 1.CC.10 (9 baskısı) veya 1.3.4.2. Sürümü) ve Dana'ya XNUMX numarası altında yol açtı.
Katı tellürde (selenyum) daha büyük miktarlarda selenyum izleri bulunabilir. Tellür nadir bir element olmasına rağmen nispeten fazla sayıda mineral bilinmektedir, çünkü tellür kendi minerallerini oluşturur, çünkü nadiren sülfidlere veya selenidlere veya sülfatlara veya selenatlara katılır; hafif homologların bu kristal kafesleri için çok büyük. Buna karşılık, daha hafif olan iki homolog, daha sık olarak tellür içeren minerallerin kristal yapılarında kafes bölgelerinde tellürü temsil eder.
Tellurium, tüm elementlerin altısına en yüksek afiniteyi gösterir ve bu nedenle genellikle altın tellürler, tellürürlü mineraller (Te2) veya ditellurid anyonları (Te22-) şeklinde bulunur. Altın ve diğer kıymetli metallere ek olarak kurşun ve bizmut, onurlu metallere ve altın cevherlerine sıklıkla eşlik eden (parajenezler) daha doğal tellürler oluşturur.
Daha nadir olarak kristal yapısında Te4 + katyonları olan mineraller bulunur; bu sayede tellüryumun en önemli oksidi, tellür dioksit TeO2 doğada ortofobik tellürit ve tetragonal paratellurit olarak iki modifikasyonda bulunur. Diğer tellür (IV) katyonları, kompleks [TeO3] 2 veya [TeO4] 4 anyonlarını içeren oksotelüratlar (IV) (tellüritler) 'dir. Oktahedral [TeO6] 6 kompleks anyonları şeklinde Te6 + katyonları içeren mineraller, çoğunlukla bakır ve kurşun içeren 21 mineralleri ile oldukça nadirdir. Bahsedilen minerallere ek olarak, Te3 + ile bir kalsiyum okso-tellurat (IV, VI) Carlfriesite CaTe8O4 dahil olmak üzere doğada karma değerlikli anlaturium mineralleri de bulunmaktadır. Katyonlar, tellür ve tellürün ayrışmasından kaynaklanan sekonder minerallerdir.
Tellurium içeren mineraller tellürün teknik üretimi için önemli değildir, çünkü nadirdirler ve madenciliğe değecek kadar şey yoktur. Zlatna (Transilvanya, Romanya) türüne ek olarak, iyi bilinen tellürum tellüryum bakımından zengin mineraller arasında Moctezuma (Meksika), Cripple Creek (Colorado), Kalgoorlie (Avustralya) ve Calaveras (Kaliforniya) bulunur. Şimdiye kadar (2012'ten itibaren) 154 tellüryum içeren mineraller bilinmektedir, ancak bunlardan beşi (dilityum, imreit, kurilit, sztrokayit, protojoseit) Uluslararası Mineraloji Derneği (IMA) tarafından bağımsız mineraller olarak tanınmamıştır veya itibarsızlaştırılmıştır.
Çıkarma ve sunum
Selenyum ile birlikte Tellurium endüstriyel olarak yalnızca büyük ölçekli elektrolitik bakır ve nikel üretiminin yan ürünlerinden elde edilir. Elde edilen anot bulamaçları, atmosferik oksijen (O2) altında 500 ° C'nin üzerindeki sıcaklıklarda (sodyum karbonat Na2CO2CO3) bulunan genel formül M32Ch (M = Cu, Ag, Au, Ch = Se, Te) genel formülünün suda çözünmeyen asil metal tellürlerini ve -selenidlerini içerir. ) reaksiyona girer. Asil metal katyonları (M +) böylece, tellürid anyonlarını okso-telluratlara (IV) (TeOXNUMX-) oksitleyen temel metallere (M) indirgenir:
Alternatif olarak, bu reaksiyon ayrıca havasız ve nitrojen oksitlerin (NO ve NO3) oluşumunda nitrik asitle (sodyum nitrat NaNO2) gerçekleştirilebilir:
Elde edilen sodyum tellurat (IV) Na2TeO3 daha sonra su içinde eritilir, burada bazik reaksiyona girer ve hidrogentellurat (IV) iyonları HTeO3- oluşturur. Telluratların (IV) aynı şekilde oluşanlardan ayrılması, suda çözünmeyen tellüryum dioksit TeO2'in içinde çöken, sülfürik asit (H4SO2) ilavesiyle nötrleştirme yoluyla bazik çözelti (IV) 'ü siler:
Tellür dioksit, elektroliz yoluyla ya da bazal tellüruma elektrolizle veya kimyasal yollarla konsantre mineral asitlerde çözülme ve sülfür dioksit SO2 eklenmesiyle indirgenebilir, sülfür, çözeltiden oluşturulan SO2 moleküllerinden (veya Soksnumx sülfit iyonlarından oluşturulur). ) ve sülfat iyonları (SO32-) oluşur:
Zon eritme işlemi, yüksek saflıkta tellür (>% 99,9) elde etmek için kullanılır.
Dünya yıllık tellür üretimi 298'teki 2013 tondan% 53 ile 457'teki 2017 tona yükseldi, yıllık ortalama 382,8 ton (t / a). Başlıca üreticiler arasında Çin (∅ 220,0 t / a), ABD (∅ 50,0 t / a), Rusya (∅ 35,6 t / a), İsveç (∅ 32,4 t / a), Japonya (∅ 31,8 t / a) ve Kanada (∅ 13,0 t / a). Tek tek ülkelerin üretim miktarlarına genel bir bakış tabloda gösterilmektedir. Almanya ve Belçika gibi diğer sanayi ülkelerinin tellür üretmesi muhtemeldir, ancak elimizde rakam yoktur. [17] Amerika Birleşik Devletleri Jeolojik Araştırmaları (USGS), 2019'teki tellürün küresel rezervlerini yaklaşık 31.000 ton olarak tahmin etmektedir.
| arazi | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| Çin | 150 | 180 | 210 | 279 | 281 | 220,0 |
| Amerika Birleşik Devletleri | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Rusya | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Schweden | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Japonya | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Kanada | 12 | 9 | 9 | 18 | 17 | 13,0 |
| uğultu | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
modifikasyonlar
Kristalin tellür
Standart koşullarda, sadece kristalli veya metalik tellür olarak adlandırılan tellürün kristalin bir modifikasyonu (Te-I veya a-Te) bilinmektedir. Α-seleniuma izotipiktir, yani aynı kristal yapıya sahiptir. P3121 (No. 152) uzay grubundaki trigonal kristal sisteminde, tellür, a = 446 pm ve c = 592 pm kafes parametreleri ve birim hücredeki üç formül birimi (kristal yapının en küçük birimi) ile kristalleşir.
Hermann Mauguin sembolizmine göre tanımlanan uzay grubu P3121 (No. 152), birim hücrenin ve mevcut simetri elemanlarının merkezlenmesini açıklar. P, Bravais kafesinin ilkel olduğu anlamına gelir. Merkezleme hakkındaki bilgiyi, uzay grubunun mevcut simetri elemanları takip eder: 31, kristalografik c eksenine paralel ([120], üç katlı bir vida eksenini (bir parçacığın 1 ° döndürmeyle çarpımı ve dönme ekseni yönünde 3/001 ile yer değiştirmesini (öteleme)) açıklar. ), 2, üç kristalografik a eksenine (<180>) paralel iki katlı bir dönme eksenini (100 ° döndürerek çarpma) açıklar, 1 simetri veya özdeşliğin tek ekseninin simetri elemanını (360 ° ile döndürerek çarpma, böylece parçacık oluşur) a eksenine ve c eksenine (<120>) dik yönde.
Kristal yapısı, x = 0,2636, y = 0 ve z = 1 / 3 konum koordinatlarına sahip, tek bir kristalografik olarak ayırt edilebilir tellüryum atomu içerir. Kristal yapının diğer tüm atomları, bu atomla uzay grubunun mevcut simetri elemanları tarafından bağlanabilir. Tellurium atomu uzay grubunun iki katlı simetri ekseni (P3121 (No. 152)) ile aynı konumda bulunduğundan, yalnızca üç katlı vida ekseni (31) ile çarpılır. Bu, c eksenine paralel kovalent olarak bağlı tellür atomlarının helisel zincirleri ile sonuçlanır. Tellurium atomları ayrı ayrı 284 pm zinciri içindedir, bağ açısı 103,1 ° 'dir. Zincirdeki bağlantılar resimlerde kırmızıyla vurgulanmıştır, bir zincir açıklık için mavi renkle gösterilmiştir, z = 1 / 3 üzerindeki koyu mavi atom, z = 2 / 3 üzerindeki orta mavi ve z = 1 veya z üzerindeki açık mavi = 0 bulunur. Bu nedenle, zincir içindeki her üçüncü atom uyumludur. Her zincir altı ek zincirle çevrilidir. Van der Waals bağları, 349 pm'nin (yeşil kesikli çizgilerle gösterilen) Te-Te mesafelerine sahip zincirler arasında bulunur; bu, tellüryum atomlarının van der Waals yarıçapının (2 · 206 pm = 412 pm) altına düşmesinden kaynaklanır. , Tek bir tellür atomu için, 6 atomları aynı zincirden geldiğinden ve bu nedenle komşu zincirlerden diğer 2'ten daha küçük bir mesafeye sahip olduğundan, 4'in koordinasyon sayısıyla sonuçlanır, daha kesin olarak 2 + 4. Bir koordinasyon polihedronu olarak, bu çarpık bir oktahedron (sarı ile vurgulanmıştır) ile sonuçlanır.
Tellurium, P3221 (# 154) yerine P3121 (# 152) alan grubunda da kristalleşebilir. 32 vida ekseni ayrıca bir atomu 120 ° etrafında döndürerek çoğaltır, ancak daha sonra 2 / 3 yerine dönme ekseni yönünde 1 / 3 ile kaydırır. Bu aynı zamanda, c ekseni boyunca saat yönünün tersine (31 vida ekseninde) değil saat yönünde çeviren sarmal zincirler oluşturur. P3221 uzay grubundaki kristal yapı (No. 154) ("sol taraf"), bu nedenle P3121 alan grubundaki yapının ayna görüntüsüdür (No. 152) ("yasal form"). Ayna görüntüsü kristal formlarının görünümüne kristalografide enantiomorfizm denir.
Tellurium kristal sistemi genellikle altıgen olarak adlandırılır. Altıgen ve trigonal kristal sistemi aynı birim hücreye dayanır, ancak altıgen bir simetri altı katlı bir simetri ekseni (6, bir parçacığın 60 ° etrafında dönerek çarpılması) varlığını gerektirir. Bununla birlikte, tellürün kristal yapısı, sadece üç katlı vida eksenini (31) içerir ve bu nedenle, alt simetrik trigonal kristal sisteminde şüphesizdir.
Kristalin tellür ile yapılan yüksek basınçlı deneylerde (Te-I veya α-tellurium) başka modifikasyonlar da keşfedildi. Değişikliklerin kararlılığı için belirtilen basınç aralıkları literatürde kısmen değişmektedir:
- Te-II, monoklinik kristal sisteminde 4 ila 6,6 GPa arasındaki basınç aralığında kristalleşir. Literatürde C2 / m (No. 12) ve P21 (No. 4) olası alan grupları olarak belirtilmiştir.
- Te-III ortofobik kristal sisteminde kristalleşir ve 6,6 GPa'nın üzerindeki basınç aralığında kararlıdır. Ortofobik bir modifikasyon için, Imma uzay grubunda teorik bir hesaplama vardır (No. 74).
- Te-IV, R3m (No. 166) uzay grubundaki trigonal kristal sisteminde kristalleşir ve pol-polonyum yapısına karşılık gelir. 10,6 ile 27 GPa arasındaki basınç aralığında kararlıdır. Zincirlerdeki tellür atomlarının ve bu modifikasyondaki bitişik zincirlere olan mesafeleri aynıdır ve her bir miktar 300 pm ile aynıdır; bu, a-Te'ye kıyasla daha yüksek simetriye yol açar.
- Te-V, 27 GPa'nın üzerinde kararlıdır. Bu değişiklik için, küp gövdeli merkezli bir kafesin (boşluk grubu Im3m (# 229)) olduğu varsayılmıştır.
Amorf tellür
Kararsız amorf modifikasyon kahverengi bir tozdur ve tellürik asitten (H2TeO3) sülfürik asit (H2SO3) veya sülfit iyonlarıyla (SO32-) reaksiyona sokularak hazırlanabilir. Böylece sülfit iyonları sülfat iyonlarına oksitlenir (SO42-); Te4 + katyonları ise elektal tellürde azalır:
Amorf tellurium standart koşullar altında yavaşça kristal modifikasyonuna dönüşür.
Fiziksel özellikleri
Kristalin tellür, 0,334 eV bant boşluğuna sahip, dahili bir doğrudan yarı iletkendir. Tüm yarı iletkenlerde olduğu gibi, elektrik iletkenliği sıcaklık veya maruziyet arttırılarak arttırılabilir, ancak bu sadece tellürde hafif bir artışa neden olur. Elektriksel iletkenlik ve termal iletkenlik, anizotropik olan tellüruma bağlı olarak hareket eder. Kristalin tellür, yumuşak (Mohs 2,25) ve toz halinde işlenmesi kolay kırılgan bir malzemedir. Basınç arttırılarak Tellurium daha fazla kristal modifikasyonuna dönüşür. 450 ° C'nin üstünde, tellür kırmızı bir eriyik içerisine geçer ve 990 ° C'nin üzerindeki sıcaklıklarda, tellür, Te2 moleküllerinin sarı çaplı bir gaz olarak bulunur. 2000 ° C'nin üzerindeki sıcaklıklarda, Te2 molekülleri tekli atomlara parçalanır.
Kimyasal özellikleri
Kristalin tellür su içerisinde çözünmez ve mineral asitlerde hidroklorik asit ve sülfürik asit ve alkalilerde zayıf çözünür. Öte yandan, nitrik asit içinde çok çözünürdür, çünkü çok güçlü bir oksitleyici ajandır ve stabil oksidasyon durumu + IV ile tellurat oluşturmak için elementel tellürü okside eder. Tellurium erimeleri bakır, demir ve paslanmaz çeliğe saldırır.
Metal olmayan bileşiklerde, tellür, hafif grup üyesi selenyum gibi davranır. Havada yeşil kaplı, mavi alevde yanar ve dioksit dioksit TeO2’i yakar:
Tellurium spontan olarak tellür halojenürler oluşturmak için halojenlerle reaksiyona girer. Dikkat çekici bir şekilde, hafif selolog ve kükürt homologlarının aksine, tellür, ayrıca + I oksidasyon durumuna sahip olan tellür iodid TeI dahil olmak üzere termodinamik olarak stabil iyodürler oluşturur. Çinko gibi baz metallerle, karşılık gelen tellüridlere şiddetli reaksiyon verir.
izotop
Tellurium, 105 ve 142 arasındaki kitle numaralı izotoplar için bilinir. Doğal tellür, sekiz izotoptan oluşan ve beşinin (122Te, 123Te, 124Te, 125Te, 126Te) stabil olduğu karma bir elementtir. İzotop 123Te, elektron yakalama altında teorik olarak 123Sb'ye bozunmalıdır. Ancak, bu bozulma henüz gözlenmedi; yarı ömrü için alt sınır 9,2 · 1016 yıl (92 katrilyon yılı) 'dır. İzotop 120Te, çift elektron yakalama yoluyla doğrudan 120Sn'e geçiş yapar. 128Te ve 130Te izotopları, sırasıyla beta radyasyonu (çift beta bozunması) emisyonuyla 128Xe ve 130Xe'ye dönüşür.
Doğal tellüruma ana katkı, yarı ömrü 130 · 7,9 yıl olan izotop 1020Te'nin yaklaşık üçte biri, ardından izotop 128Te'dir. Bu nedenle doğal tellür izotoplarının ortalama atom kütlesi, periyodik tablodaki 127,60 ile saf element iyodininkinden daha büyük olan 126,90'tir. 128Te, tüm elementlerin stabil olmayan izotoplarının en yavaş bozunumuyla izotop olarak kabul edilir. Yarı ömürlü 7,2 · 1024 yıl (7 katrilyon yıl, yani 1 kilogram cinsinden bir atom çürümesi) ile aşırı yavaş bozunma, yalnızca bir atom çürümesini her 18 ayda çürümekte) ancak çok eski doğal tellürum numunelerinde çürüme ürünü (128Xe) tespit edilerek belirlenebilir.
Diğer izotoplardan, çekirdek izomeri 121mTe, 154 günleriyle en uzun yarı ömre sahiptir. Ayrıca 127Te ve 129Te izotopları için, izomerlerin yarı ömürleri temel durumun üstündedir. En yaygın kullanılan izleyici, 127Te izotopudur ve bunu 121Te izler. 127Te ve 129Te izotopları, nükleer reaktörlerde nükleer fisyonda fisyon ürünleri olarak da görülür.
Kullanım
Tellurium, teknik olarak daha az önemli bir elementtir çünkü üretimi pahalıdır ve diğer elementler veya bileşikler genellikle kullanımda eşdeğerdir. 2016 yılında, oda sıcaklığı ile 400 ° C arasında yüksek bir erdem rakamı ile temel, polikristalin ve katkılı tellür termoelektrik davranışı gösterildi. Elemental tellür, metal endüstrisinde çelik, dökme demir, bakır ve kurşun alaşımları ve paslanmaz çelik için katkı maddesi olarak (<% 1) kullanılır. Korozyon direncini artırır ve mekanik özellikleri ve işlenebilirliği iyileştirir. Saf tellür şimdiye kadar sadece nadiren yarı iletken olarak kullanılmıştır; tellür çoğunlukla II-VI bileşik yarı iletkenlerinde kullanılır. Kadmiyum tellürür CdTe z'dir. B. ışıktan elektrik üretmek için fotodiyotlarda ve ince film güneş pillerinde kullanılır.
Bizmut tellürür Bi2Te3, termokupllarda, termoelektrik jeneratörlerde (örneğin radyonüklid pillerde) veya soğutma için Peltier elemanlarında elektrik üretmek için kullanılır.
Germanyum GeTe ve antimon tellürür Sb2Te3'in kombinasyonları, optik depolama disklerinin (örneğin CD-RW) bir parçası olarak faz değişim malzemelerinde veya faz değişikliği rasgele erişim belleği gibi yeni depolama malzemelerinde kullanılır.
Yüksek kırılma endeksleri nedeniyle, optik dalga kılavuzlarında SiO2 silika cam yerine TeO2 tellüryum dioksit camları kullanılır.
Mikrobiyolojide, renksiz potasyum tellurat (IV) K2TeO3 karma agar, stafilokok ve Corynebacterium diththeriae tespiti için seçici bir besiyeri olarak kullanılır. Bakteriyel koloniler, Te4 + katyonlarını elementer tellürde azalttıkları ve hücrelerinde sakladıkları için küçük siyah küreler gibi görünürler.
Tellurium (veya potasyum tellurat), ilk kez tüberkülozlu hastalarda gece terlemesinin tedavisi için 1890 tarafından tıbbi olarak kullanılmıştır.
Ayrıca, küçük miktarlarda tellür, kauçuğun vulkanizasyonunda, patlatıcılarda ve cam ve seramiklerin boyanmasında kullanılır. Tellurium tuzları kısmen havai fişeklerde yeşil çimen rengi üretmek için kullanılır.
Güvenlik talimatları ve toksisite
Çözünür formda tellür, insan organizması için zehirli bir elementtir ve bu nedenle geçmişte zehirli olarak sınıflandırılmıştır. Bununla birlikte, elemental tellür suda ve vücudun kendi asitlerinde çok az çözünür olduğundan, zararlıya indirgenmiştir. Hollanda Uygulamalı Bilimsel Araştırma Örgütü (TNO) tarafından yapılan araştırmalar, sıçanlar için LD50 (oral) değerinin> 5000 mg / kg olduğunu göstermiştir. NF Ismerow tarafından Tek Maruz Kalma Altında Endüstriyel Toksik Kimyasalların Toksikometrik Parametreleri kitabındaki birçok güvenlik veri sayfasında verilen 83 mg / kg değeri, [1982] sadece kolayca çözünür tellür bileşikleri için geçerlidir. Buna rağmen, çeşitli üreticiler elemental tellür (toz) için eski LD26 değerini ve H-ifadesi 50 ("Yutulursa toksik") ile bağlantılı olarak toksik sınıflandırmayı kullanmaya devam etmektedir.
Tellurium selenyum kadar toksik değildir. Bu, 5'in komşu elemanlarına benzer. Antimonun ayrıca arsenikten daha az toksik olduğu ana grup. Tellurium, özellikle alkali metal tellatratlar (örn. Na2TeO3) gibi vücutta yutulması (peroral) gibi kolayca çözülebilen tellürum bileşikleri formunda, toksik dimetiltelluride (Me2Te: H3C-Te-CH3'in neden olduğu, karaciğere zarar verir), Kalp ve böbreklere neden olabilir. Kolayca çözülebilir tellurium bileşikleri çok daha fazla tellürumu açığa çıkardığından, bunlar ayrıca daha tehlikeli olarak sınıflandırılır. Tellurium zehirlenmesi, ilk olarak Christian Gottlob Gmelin, 1824 (ilk kez tellürün canlılar üzerindeki etkileri üzerine yaptığı çalışmalar için) tarafından dimetiltelluridin neden olduğu, solunabilir havanın yoğun bir sarımsak kokusunda kendini gösterir. Bu, ciddi zehirlenmeye neden olmayan çok düşük seviyelerde bile gelişmek ve gelişmek için birkaç hafta alacaktır. Bu sarımsak kokusu, gerçek sarımsaktan farklı olarak, dişlerinizi fırçalayarak alınamaz. Aynı zamanda bir odaya yerleşir ve sadece birkaç saat sonra taşınır. Aynı zamanda cilt yoluyla yavaşça atılır.
Tellurst tozları havada kendiliğinden tutuşabilir ve karşılık gelen bir konsantrasyonda ince bir şekilde dağıldığında, her durumda tellür dioksit TeO2 oluşturan, patlayıcı reaksiyona girebilir. Diğer metal tozları gibi, tellür tozu da brom pentaflorür BrF5 gibi interhalojen bileşiklerle patlayıcı reaksiyona girebilir. Tellurium için maksimum işyeri konsantrasyonu (MAK) oluşturulmamıştır.
kanıt
Elemental tellür sıcak kırmızı sülfürik asitte (H2SO4) kırmızı Te42 + katyonunu (tetratellurik diasyon) oluşturmak için tellürün oksidasyonu ile tespit edilebilir. Sülfürik asidin bir kısmı, sudaki yüksek sıcaklıklar (H2O) ve bunun gibi gaz olarak kaçan anhidrid sülfür dioksit (SO3) nedeniyle ayrışan sülfürik aside (H2SO2) verilen reaksiyonda azalır:
Kare düzlemsel Te42 + katyonunun rengi, görünür ışığın bir kısmını emen altı adet delokalize π elektrondan kaynaklanmaktadır. Kalan, emilmeyen ışık dalga boyları tamamlayıcı renge kırmızı verir.
Tellurat ve tellürit polarografi ile tanımlanabilir, yani seçici olarak yan yana belirlenebilir. Tellurat seviyesi -1,66 V iken, tellürit -1,22 V'de görünür (SCE, 0,1 M kostik soda). Her iki tellurium türü tellürde bir adımda azalır. % 0,03 tellurat veya% 0,003 tellurite izleri bu şekilde tespit edilebilir. Belirgin derecede daha güçlü, atomik spektroskopinin yöntemleridir. Alev AAS, 20 μg / l saptama sınırına ulaşırken, bu değer, grafit tüp AAS (0,2 μg / l) ve hidrit tekniği (0,02 μg / l) için çok daha düşüktür.
tellür
Bileşiklerde, tellür, en sık oksidasyon durumlarında -II (telluritler) ve + IV (tetrahalidler, tellür dioksit ve telluratlar (IV), modası geçmiş tellüritler) meydana gelir. Daha nadir olarak oksidasyon durumları + VI (telluratlar (VI)) ve + II (dihalidler) yanı sıra -I (ditelluritler) ve + I (yalnızca TeI olarak bilinen monohalidler) bulunur.
Hidrojen bileşikleri
Tellurik Hidrojen H2Te, tellürlerin (MxTey) hidroklorik asit HC1 gibi güçlü asitlerle reaksiyonu ile üretilen renksiz, oldukça toksik bir gazdır. Elementlerden (hidrojen ve tellür), bileşik sadece 650 ° C'nin üzerindeki sıcaklıklarda güçlü bir endotermik bileşik olarak temsil edilebilir. Suda çözünen (tellürik asit), asidik reaksiyona girer, asitlik yaklaşık olarak fosforik aside karşılık gelir. Havada, sulu çözelti derhal su ve elementel tellürde ayrışır.
oksijen bileşikleri
Tellurium dioksit (tellür (IV) oksit) TeO2 renksiz bir kristal katı ve tellürün en önemli oksididir. Elementel tellürün hava ile yanmasından kaynaklanır. Zayıf amfoterik ve kararsız tellurik asit H2TeO3'un anhidritidir. Tellurium dioksit ortofobik (tellürit) ve doğada mineraller olarak da meydana gelen bir dörtgen (paratellurit) modifikasyonunda bulunur.
Tellurium trioksit (tellür (VI) oksit) TeO3 sarı, trigonal / rhombohedral kristalleşen bir katı ve orthotellurik asit H6TeO6'un anhidritidir. Orthotelluric asidin drenajından, sıcaklıktaki kuvvetli bir artıştan kaynaklanır. Sarı renk, oksijenin tellüruma elektron transferinden ("yük transferi") kaynaklanmaktadır.
Tellurium monoksit (tellür (II) oksit) TeO bir başkadır, ancak standart koşullar altında tellürün kararsız oksididir. Siyah amorf bir katı olarak tarif edilir ve daha kararlı tellür dioksit TeO2 oluşturmak için nemli havada oksijenle reaksiyona girer.
Dikelüler pentoksit (tellür (IV) tellür (VI) oksit), Te4 + ve Te6 + katyonlarıyla karışık bir tellür oksittir. Ayrıca orthotellurik asidin termal ayrışmasında başka bir ürün anlatürum trioksit eklenir ve monoklinik kristal sisteminde kristalleştirilir.
Telluratlar, orthotellurik asit H6TeO6 ve metatellurik asit H2TeO4'in anyonları [TeO6] 6- veya [TeO4] 2- tuzlarıdır. Anyon [TeO2] 3 - ile birlikte anlaturik asit H3TeO2 tuzlarına telluratlar (IV) (eski anlaturitler) adı verilir.
halojen bileşikleri
Tetrahalides TeX4 + IV oksidasyon durumunda tellür ile en yaygın tellür halojenürleridir. Bunlar tüm halojenlerle (fluor, klor, brom ve iyot) bilinir. Tüm bileşikler kristal katıdır.
+ II oksidasyon durumunda tellür ile dihalidler TeX2 sadece klor, brom ve iyot ile bilinir, sadece gaz fazında bulunurlar.
Monohalidler TeX, sadece tellür iyodür TeI olarak iyot ile tellürde bulunur. Bu, termo-dinamik olarak stabil kalkojenlerin mono-iyodürü ve koyu kristalimsi bir katıdır. Bu bileşikteki Tellurium olağandışı oksidasyon durumuna + I sahiptir.
Althalidler, + I'den küçük bir oksidasyon durumuna sahip Te içerir. Kararlı temsilcileri Te2I, Te2Br ve Te3Cl2'tir.
+ VI oksidasyon durumunda tellür ile heksalidler TeX6 sadece tellür heksafluorür TeF6 veya tellür pentaflorür klorür TeF5Cl olarak bilinir. Her ikisi de renksiz gazlardır. Tellurium hexafluoride en reaktif kalkojen hexafluoride (kükürt hexafluoride SF6 ve selenyum hexafluoride SeF6 dışında) ve suda hidrolize olan tek kişidir.
Ayrıca, sulu çözeltideki + IV oksidasyon durumundaki tellür, ayrıca tüm halojenür iyonlarıyla kompleks bileşikler [TeX6] 2- (X = F-, Cl-, Br-, I-). Hexafluoro kompleksi hariç, diğerleri yapı içinde mükemmel bir oktahedraldir ve ayrıca çözeltiden elde edilen tuzlar olarak da çökeltilebilir (örneğin, sarı amonyum heksakloridotelürat (IV) (NH4) 2 [TeCl6], kırmızımsı kahverengi amonyum hekzabromidotellurat (IV) (NHXUMX) (NHXUMX) 4 [TeBr2] veya siyah sezyum hexaiodidotellurate (IV) Cs6 [TeI2]).
Organotellurium bağlantıları
Tellurium, bir dizi organometalik bileşik oluşturur. Bununla birlikte, bunlar çok dengesizdir ve organik sentezde çok az kullanılırlar. R2Te, R2Te2, R4Te ve R6Te formundaki saf tellürum organil bileşikleri (R'nin her biri alkil, aril) bilinmektedir.
Ek olarak, diorganotellur dihalidler R2TeX2 (R = alkil, aril; X = F, Cl, Br, I) ve triorganotellurhalid R3TeX (R = alkil, aril, X = F, Cl, Br, I) de bilinmektedir.
Tellurpolykationen
Polycation Te72+ Te içinde7[Be2Cl6]
Telluriumun dikkatlice oksidasyonu ile, daha önce sözü edilen Te42 + 'a ek olarak, Tenx +' in sayısız tellüryum poliçeleri hazırlanabilir ve uygun bir karşı iyonla kristalleştirilebilir. Sünnet zayıf bir Lewis bankası olmalıdır, çünkü tellür poliksiyonları nispeten güçlü Lewis asitleridir. Uygun oksitleyici ajanlar genellikle, tipik olarak 200 ° C sıcaklıkta doğrudan istenen bileşiği veren geçiş metallerinin halojenürleridir:
Sıklıkla, kristalleşme kimyasal taşıma koşulları altında başarılı olur, ancak bazen stannik klorür veya silikon tetrabromid gibi susuz çözücüler kullanılmalıdır. Bazı durumlarda erimiş tuzlar da uygun reaksiyon ortamıdır: Metal halojenür, genellikle ana grup elementlerinin halojenürlerinde olduğu gibi uygun bir oksitleyici ajan değilse, karşılık gelen tellür tetrahalidleri oksitleyici ajanlar olarak kullanılabilir:
Karşı iyon ve reaksiyon ortamını değiştirerek, çok çeşitli polisikasyonlar gösterilebilir; Karışık selenyum-tellür poliksiyonlarına, sentez reaktanlarının uygun seçimi ile de erişilebilir. Gösterilen zincire veya bant şeklindeki poliksiyonlara ek olarak, Te62 +, Te64 + ve Te84 + gibi izole polisikasyonlar da vardır.
Tellurium fiyatı
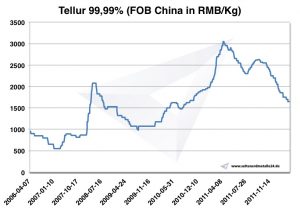
Grafik Tellurium 2006-2011
Tellür fiyatları -> stratejik metal fiyatları










![{\ mathrm {8 \ Te \ + \ 2 \ UBr_ {5} \ longrightarrow \ Te_ {8} [U_ {2} Br _ {{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
