Galyum, Ga, atom numarası 31
Galyum - Galyum fiyatı, oluşumu, ekstraksiyonu, kullanımı
Allgemein
galyum Ga element sembolü ve atom numarası 31 ile nadiren oluşan bir kimyasal elementtir. Periyodik tabloda 4. periyotta olup 3. ana grup (grup 13) veya bor grubunun üçüncü elementidir. Sıvılaştırılması kolay gümüş-beyaz bir metaldir. Galyum, normalde metallerde bulunan kristal yapılardan birinde kristalleşmez, ancak galyum dimerleri ile ortorombik bir yapıdaki en kararlı modifikasyonunda kristalleşir. Ek olarak, özel kristalizasyon koşulları altında veya yüksek basınç altında oluşan altı başka modifikasyon bilinmektedir. Metal, kimyasal özellikleri bakımından alüminyuma çok benzer.
Doğada galyum yalnızca küçük bir ölçüde ve çoğunlukla alüminyum, çinko veya germanyum cevherlerinde bir karışım olarak bulunur; Galyum mineralleri çok nadirdir. Buna göre alüminyum veya çinko üretiminde de yan ürün olarak elde edilmektedir. Galyumun çoğu, çoğunlukla ışık yayan diyotlar için kullanılan yarı iletken galyum arsenide işlenir.
Bulunduğu
Galyum, kıta kabuğunda 19 ppm içeriği ile yeryüzünde nadir bulunan bir elementtir, bolluğu lityum ve kurşununki ile karşılaştırılabilir. Elementel formda değil, sadece bağlı formda, esas olarak alüminyum, çinko veya germanyum cevherlerinde oluşur. Galyum açısından en zengin cevherler arasında boksit, çinko blende cevherleri ve germanit bulunur.
Galyum içeriği çoğunlukla düşüktür, Surinam'da bulunan ve bilinen en yüksek içeriğe sahip boksit yalnızca% 0,008 galyum içerir. Dünya genelinde boksitteki galyum rezervleri 1,6 · 10'dur6 Ton tahmini. Germitte% 1'e kadar daha yüksek galyum içeriği bulunur. Yalnızca ABD'nin Utah eyaletindeki Apex madeninde o kadar yüksek cevher kaliteleri var ki, galyum çıkarmak için madencilik girişiminde bulunuldu. Ancak bu, karlılık nedeniyle kısa bir süre sonra başarısız oldu.
Sadece birkaç galyum minerali bilinmektedir, bunlar arasında esas olarak Namibya'daki Tsumeb'de bulunan gallit (CuGaS) bulunmaktadır.2), Söhngeit (Ga (OH)3) ve tsumgallite (GaO (OH)).
Çıkarma ve sunum
Galyum, Bayer işleminde boksitten alüminyum üretiminde bir yan ürün olarak elde edilir. Sodyum hidroksit çözeltisi içinde çözülmüş sodyum alüminat ve sodyum galat karışımı, başlangıç ürünü olarak hizmet eder. Galyum, çeşitli işlemler kullanılarak alüminyumdan ayrılabilir. Bir olasılık, karbon dioksit yardımı ile fraksiyonel kristalizasyondur, alüminyum hidroksit başlangıçta tercihen çökelirken, sodyum hidroksit çözeltisinde daha fazla çözünür sodyum galat birikir. Galyum hidroksit, ancak alüminyum hidroksit ile karıştırılarak sonraki işlem aşamalarından sonra çökeltilir. Karışım daha sonra sodyum hidroksit çözeltisi içinde çözülür ve galyum elektrolizle elde edilir. Bu süreç enerji ve emek yoğun olduğu için sadece Çin Halk Cumhuriyeti gibi düşük maliyetli ülkelerde kullanılmaktadır.
Galyum ayrıca elektroliz yoluyla doğrudan sodyum hidroksit çözeltisinden elde edilebilir. Bu amaçla cıva katotları kullanılır, elektroliz sırasında bir galyum amalgamı oluşur. Çözeltiye sodyum amalgam eklemek de mümkündür.
Şelatlama ligandları olarak özel hidroksikinolinlerin yardımıyla, gazyağı ile sodyum hidroksit çözeltisinden galyumu çıkarmak ve böylece alüminyumdan ayırmak mümkündür. Ayrıca ekstrakte edilen diğer elementler seyreltik asitlerle ayrıştırılabilir. Kalan galyum bileşiği daha sonra konsantre hidroklorik veya sülfürik asit içinde çözülür ve elektrolitik olarak metale indirgenir.
Birçok teknik uygulama için çok saf galyum gereklidir; örneğin yarı iletkenler için, yalnızca yüz milyonda biri yabancı madde içerebilir. Olası temizleme yöntemleri vakumlu damıtma, fraksiyonel kristalizasyon veya bölge eritmedir.
Üretilen galyum miktarı azdır, 2008 yılında dünya birincil üretimi 95 tondur. Bir diğer önemli kaynak da, 2008 yılında 135 ton galyumun daha çıkarıldığı galyum içeren atığın geri dönüştürülmesidir. Ana üretici ülkeler, galyum geri dönüşümü için Çin Halk Cumhuriyeti, Almanya, Kazakistan ve Ukrayna, ayrıca Amerika Birleşik Devletleri, Japonya ve Birleşik Krallıktır.
Laboratuvar ölçeğinde galyum, platin veya tungsten elektrotlar üzerinde sodyum hidroksit çözeltisi içinde bir galyum hidroksit çözeltisinin elektrolizi ile temsil edilebilir.
özellikleri
Fiziksel özellikleri
Galyum, gümüşi beyaz, yumuşak (Mohs sertliği: 1,5) bir metaldir. 29,76 ° C olan metaller için alışılmadık derecede düşük bir erime noktasına sahiptir. Cıva ve sezyumdan sonra en düşük erime noktasına sahip metaldir ve bu da komşu elementler olan alüminyum ve indiyumun çok altındadır. Bu muhtemelen, diğer metallerin yapılarının aksine yüksek derecede simetriye sahip olmayan ve bu nedenle çok kararlı olmayan sıradışı kristal yapıdan kaynaklanmaktadır. Kaynama noktası 2204 ° C'de nispeten yüksek olduğu için galyum sıvı olduğu alışılmadık derecede geniş bir alana sahiptir. Zor kristalleşme nedeniyle, sıvı galyum erime noktasının altında (alt soğutma) kolayca soğutulabilir ve kristalleşme çekirdekleri oluştuğunda aniden kristalleşir.
Silikon, diğer bazı elementler ve su gibi galyumun da yoğunluk anormalliği vardır; sıvı haldeki yoğunluğu katı formdakinden yaklaşık% 3,2 daha yüksektir. Bu, katı halde moleküler bağlara sahip maddeler için tipiktir.
Galyum katı halde diyamanyetiktir, ancak sıvı halde paramanyetik hale gelir ( = 2,4 10-6 40 ° C'de)
= 2,4 10-6 40 ° C'de)
Galyum-galyum bağlarının oluşumu, yapılarının karakteristiğidir. Farklı kristalizasyon koşulları altında (bilinen dört modifikasyon, α- ila δ-galyum, normal basınç altında) ve basınç altında (toplam üç yüksek basınç modifikasyonu, Ga-II, Ga-III, Ga-IV) oluşan çeşitli modifikasyonlar bilinmektedir. Oda sıcaklığında en kararlı değişiklik, ortorombik bir katman yapısında kristalleşen a-galyumdur. Her durumda, kovalent bir bağ yoluyla birbirine bağlanan iki atom bir dimer oluşturur. Her bir galyum atomu ayrıca diğer dimerlerin diğer altı atomuna bitişiktir. Tek tek dimerler arasında metalik bağlar mevcuttur. Galyum dimerleri o kadar kararlıdır ki, eriydiklerinde bile başlangıçta tutulurlar ve ayrıca gaz fazında da tespit edilebilirler.
Aşırı soğutulmuş sıvı galyumun kristalleşmesi sırasında başka modifikasyonlar meydana gelir. -16,3 ° C'de, monoklinik kristal yapıya sahip β-galyum oluşur. Yapıda galyum atomlarının paralel zikzak zincirleri vardır. -19,4 ° C'lik bir sıcaklıkta kristalleşme meydana gelirse, α-boron ile karşılaştırıldığında on iki galyum atomundan oluşan bozulmuş ikosahedranın bulunduğu trigonal δ-galyum oluşur. Bunlar, ayrı ayrı galyum atomları aracılığıyla birbirine bağlanır. −35,6 ° C'de, γ-galyum nihayet oluşur. Bu ortorombik modifikasyonda, tüpler birbirine bağlı Ga7Diğer galyum atomlarının doğrusal bir zincirinin ortasındaki halkalar.
Galyum, oda sıcaklığında yüksek basınç altına yerleştirilirse, basınç arttırıldığında birbiri ardına çeşitli yüksek basınç modifikasyonları oluşur. Kübik galyum-II modifikasyonu, her bir atomun sekiz tane daha ile çevrildiği 30 kbar'ın üzerinde stabildir. Basınç 140 kbar'a yükseltilirse, metal şimdi indiyumunkine karşılık gelen bir yapıda tetragonal galyum-III olarak kristalleşir. Basınç yaklaşık 1200 kbar'a yükseltilirse, sonunda galyum IV'ün yüz merkezli kübik yapısı oluşur.
Kimyasal özellikleri
Galyumun kimyasal özellikleri alüminyuma benzer. Bunun gibi galyum, havada yoğun bir oksit tabakasının oluşmasıyla pasifleştirilir ve reaksiyona girmez. Metal, yalnızca yüksek basınçta saf oksijende, oksit oluşturmak için parlak bir alevle yanar. Benzer şekilde, burada çözünmeyen galyum hidroksit oluştuğu için su ile de reaksiyona girmez. Öte yandan, galyum alüminyum ile alaşımlanmışsa ve erime noktasının düşmesi nedeniyle oda sıcaklığında sıvı ise, su ile çok şiddetli reaksiyona girer. Galyum ayrıca, karşılık gelen GaX tuzlarını oluşturmak için halojenlerle hızlı bir şekilde reaksiyona girer.3.
Galyum amfoteriktir ve hidrojen evrimi ile hem asitlerde hem de bazlarda çözünür. Alüminyum gibi asitlerde, Ga ile tuzlar oluşur.3+İyonlar, [Ga (OH) formundaki bazlarda galatlar halinde4]-. Seyreltik asitlerde yavaş, aqua regia ve konsantre kostik soda'da çabuk çözünür. Galyum nitrik asitle pasifleştirilir.
![\ mathrm {2 \ NaOH + 2 \ Ga + 6 \ H_2O \ rightarrow 2 \ Na [Ga (OH) _4] + 3 \ H_2 \ uparrow}](https://upload.wikimedia.org/wikipedia/de/math/7/e/6/7e633a1c6ed8f76b3ebfabbcaba5e544.png)
- Galyumun kostik soda ile reaksiyonu
Çoğu metal sıvı galyum tarafından saldırıya uğrar, bu nedenle yalnızca kuvars, cam, grafit, alüminyum oksit, tungsten, 800 ° C'ye kadar ve tantaldan yapılmış kaplarda 450 ° C'ye kadar saklanabilir.
izotop
Arasında toplam 30 galyum izotopu vardır. 56Ga ve 86Ga ve diğer yedi çekirdek izomeri bilinmektedir. Bunlardan ikisi 69Ga ve 71Ga kararlı ve doğada da ortaya çıkar. Doğal izotopik bileşimde baskın 69% 60,12 ile Ga,% 39,88 71Kararsız izotoplarından Ga. 673,26 gün ile Ga, en uzun yarı ömür, diğer yarı ömürler saniyeden maksimum 14,1 saate kadar değişir 72Ga.
İki galyum izotop, 67Ga ve 67,71 dakikalık yarı ömre sahip kısa ömürlü olan 68Ga, nükleer tıpta pozitron emisyon tomografisi için izleyiciler olarak kullanılmaktadır. 67Ga bir siklotronda üretilirken, 68Siklotron gerekmez. Bunun yerine, daha uzun ömürlü germanyum izotopu 68Işınlama tarafından Ge 69Protonlarla oluşturulan Ga. Bu parçalanıyor 68Ga, sonuç 68Ga bir galyum 68 jeneratöründe çıkarılabilir. Çalışmalar için galyum genellikle 1,4,7,10-tetraazasiklododekan-1,4,7,10-tetraasetik asit (DOTA) gibi güçlü bir şelatlayıcı ligand ile bir komplekse bağlanır.
Kullanım
Elementin nadir olması nedeniyle galyum yalnızca sınırlı bir ölçüde kullanılır. Üretilen galyumun çoğundan çeşitli galyum bileşikleri yapılır. Ekonomik açıdan açık ara en önemlileri, diğer şeylerin yanı sıra güneş pilleri ve ışık yayan diyotlar için gerekli olan özellikle galyum arsenit olmak üzere 5. ana grubun unsurlarına sahip olanlar. 2003 yılında üretilen galyumun% 95'i bu amaçla kullanıldı. Aynı zamanda silikon katkısı (p-doping) için bir malzeme görevi görür.
Termometrelerin yapımında elementin sıvı olduğu geniş sıcaklık aralığı ve aynı zamanda düşük buhar basıncı kullanılır. Galyum termometreler 1200 ° C'ye kadar kullanılabilir. Sıvı galyum, yüksek sıcaklıklarda gazların hacmini ölçmek için bariyer sıvısı olarak ve indiyum gibi ultra saf metallerin ekstraksiyonunda sıvı elektrot malzemesi olarak kullanılabilir.
Galyum yüksek bir ıslanabilirliğe ve iyi yansıtma özelliğine sahiptir ve bu nedenle aynalar için bir kaplama olarak kullanılır. Ayrıca, erimiş alaşımlarda, nükleer reaktörlerdeki ısı eşanjörlerinde ve lambalardaki cıva yerine kullanılır.
Diğer metallerle galyum alaşımlarının çeşitli kullanımları vardır. Manyetik malzemeler gadolinyum, demir, itriyum, lityum ve magnezyum ile alaşım yapılarak oluşturulur. Bileşim V'deki vanadyumlu alaşım3Ga, 16,8 K gibi nispeten yüksek bir geçiş sıcaklığına sahip bir süper iletkendir. Nükleer silahlarda, faz değişikliklerini önlemek için plütonyum ile alaşımlanmıştır. Galinstan gibi birçok galyum alaşımı, oda sıcaklığında sıvıdır ve toksik civanın veya çok reaktif sodyum-potasyum alaşımlarının yerini alabilir.
kanıt
Galyum, çeşitli tipik renk reaksiyonları ile kalitatif olarak tespit edilebilir. Bunlar arasında, galyum eklendiğinde turuncu-sarıdan kırmızı-menekşeye floresan benzen içindeki rodamin B ile, alüminyum ile reaksiyonda olduğu gibi yeşil floresan gösteren morin ve galyum ile potasyum heksasiyanidoferrat (III), galyum heksasiyanidoferrat (III ) formlar. Ayrıca, 417,1 ve 403,1 nm'de karakteristik mor spektral çizgilerle spektroskopik bir tespit mümkündür.
Nicel kanıt, kompleksometrik titrasyonlarla, örneğin etilendiamintetraasetik asitle veya atomik absorpsiyon spektrometresiyle sağlanabilir.
Toksikoloji ve biyolojik önemi
Galyum metal için toksikolojik veri bulunmamaktadır; ancak cilt ve mukoza zarlarını aşındırır. Bileşikler galyum (III) nitrat Ga (NO3)3 ve galyum (III) oksit Ga2O3 oral LD'ye sahip50Gram aralığındaki değerler: nitrat için 4,360 g / kg ve oksit için 10 g / kg. Galyum bu nedenle düşük toksisiteye sahip olarak kabul edilir ve bilindiği kadarıyla insanlarda iz element olarak hiçbir rol oynamaz.
Bağlantıları
Bileşiklerde galyum neredeyse yalnızca +3 oksidasyon durumunda oluşur. Ek olarak, nadir ve genellikle çok kararsız galyum (I) bileşiklerinin yanı sıra hem mono- hem de üç değerlikli galyum (resmi olarak galyum (II) bileşikleri) içerenler de bilinmektedir.
Azot grubu elementleri ile bileşikler
Galyumun teknik olarak en önemli bileşikleri, nitrojen grubu elementlerine sahip olanlardır. Galyum nitrür, galyum fosfit, galyum arsenit ve galyum antimonid tipik yarı iletkenlerdir (III-V yarı iletkenler) ve elektronikteki transistörler, diyotlar ve diğer bileşenler için kullanılır. Özellikle, çeşitli renklerde ışık yayan diyotlar, galyum ve nitrojen gruplarının bileşikleri olarak üretilir. Bant aralığına bağlı olan renk, anyonların farklı oranları ile veya galyumun alüminyum veya indiyum ile değiştirilmesiyle ayarlanabilir. Galyum arsenit ayrıca güneş pilleri için kullanılır. Bunlar özellikle uydularda kullanılır, çünkü galyum arsenit iyonlaştırıcı radyasyona silikondan daha dirençlidir.
halidler
GaX formunun galyum halojenürleri3 birçok özellik bakımından ilgili alüminyum bileşiklerine benzer. Galyum (III) florür haricinde, alüminyum bromür yapısında dimerler olarak bulunurlar. Galyum (III) klorür, ekonomik önemi az olan tek halojenürdür. Friedel-Crafts reaksiyonlarında Lewis asidi olarak kullanılır.
Diğer bağlantılar
Alüminyum oksit gibi galyum (III) oksit de renksiz, yüksek erime noktalı bir katıdır. Kübik β modifikasyonunun en kararlı olduğu beş farklı modifikasyonda oluşur.
Organik galyum bileşikleri şu şekilde bulunur: Gallane GAR3, Gallylene GAR ve as yüksek gallansgalyum-galyum bağları içerenler. Diğer birçok organometalik bileşik gibi, hava ve hidrolize karşı kararsızdırlar. Ekonomik öneme sahip birkaç organik galyum bileşiğinden biri, bir doping reaktifi olarak ve organometalik gaz fazı epitaksisinde ince galyum arsenit ve galyum nitrür tabakalarının üretimi için kullanılan trimetilgalyumdur.
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| İsim, sembol, atom numarası | Galyum, Ga, 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| dizi | madenler | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, dönem, blok | 13, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||
| Görünüş | gümüşi beyaz | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS numarası | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Yer kabuğunun kütle kesri | 14 sayfa / dakika'ya kadar | ||||||||||||||||||||||||||||||||||||||||||||||||
| nükleer | |||||||||||||||||||||||||||||||||||||||||||||||||
| atomik kütle | 69,723 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atom yarıçapı (hesaplanmış) | 130 (136) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent yarıçapı | 122 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals yarıçapı | 187 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| elektron konfigürasyonu | [Ar] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. iyonlaşma | 578,8 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. iyonlaşma | 1979,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. iyonlaşma | 2963 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| fiziksel olarak | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fiziksel durum | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| modifikasyonlar | yedi | ||||||||||||||||||||||||||||||||||||||||||||||||
| yoğunluk | 5,904 g / cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs sertliği | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| manyetizma | diyamanyetik ( = -2,3 10-5) = -2,3 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| ergime noktası | 302,91 K (29,76 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| kaynama noktası | 2477 K (2204 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molar hacmi | 11,80 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| buharlaşma ısısı | 256 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| kaynaşma ısısı | 5,59 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| sesin hızı | 2740 K'de 293,15 m / s | ||||||||||||||||||||||||||||||||||||||||||||||||
| Özgül ısı kapasitesi | 371 J / (kg K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektriksel iletkenlik | Hakkında 7,14 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ısı iletkenliği | 29 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| kimyasal | |||||||||||||||||||||||||||||||||||||||||||||||||
| oksidasyon durumları | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normal potansiyel | −0,53 V (Ga3+ + 3 e- → Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| elektronegatiflik | 1,81 (Pauling ölçeği) | ||||||||||||||||||||||||||||||||||||||||||||||||
| izotop | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| emniyet | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
Galyum fiyatları, çizelgeler, fiyat
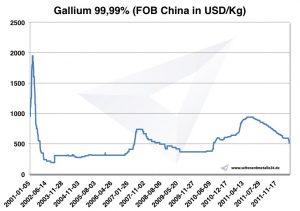
Grafik Gallium 2001-2011
Galyum Fiyatları -> Stratejik metal fiyatlarında Galyum Fiyatları
